江苏省苏州市工业园区九年级5月中考二模化学试卷
苏州一直实施的“蓝天工程”目的就在于治理PM2.5等大气污染物,改善城市空气质量,它包括
①节能减排,加大产业结构的调整,加快淘汰落后产能
②加强建筑工地、道路扬尘控制和加油站油气回收工作
③禁止垃圾、秸秆焚烧
④发展城市公共轨道交通和和快速交通
⑤提升车用燃油品质,推广新能源汽车
⑥禁止开私家车,选择绿色出行
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②④⑤⑥ | D.①②④⑤ |
下列各物质中,均属纯净物的是
| A.碳酸钙生铁 | B.液态空气液氧 | C.冰水干冰 | D.医用酒精碘盐 |
下列属于物理变化的是
| A.天然气燃烧 | B.铁在潮湿的环境中生锈 |
| C.石油分馏得到汽油 | D.煤干馏得到焦炭 |
下列关于氧气的说法中,错误的是
| A.氧气用于炼钢,目的是除去生铁中多余的碳和其他杂质 |
| B.氧气可以支持燃烧,说明氧气具有助燃性 |
| C.氧气可以供给呼吸,是因为和体内物质反应而释放能量,维持生命活动 |
| D.夏天鱼池内放增氧泵,是因为温度升高,氧气在水中溶解增大 |
下图容器中分别存放药品正确的是
① ② ③ ④
| A.①碳酸氢铵② 蒸馏水③ 氢氧化钠溶液④ 盐酸溶液 |
| B.① 碱式碳酸铜② 氢氧化钠溶液③ 酚酞溶液④ 盐酸溶液 |
| C.① 盐酸溶液② 氢氧化钠溶液③ 酚酞溶液④ 碱式碳酸铜 |
| D.① 碳酸钙②盐酸溶液③ 酚酞溶液④ 氢氧化钠溶液 |
下列关于电解水的叙述中错误的是
| A.电解水的实验证明水是由氢分子、氧分子组成的 |
| B.在水电解器中加满水,然后接通直流电源 |
| C.为增强水的导电性,常在水中加入一定量的稀硫酸或氢氧化钠溶液 |
| D.与电源负极相连的玻璃管内得到的气体能在空气中燃烧 |
分析各组微粒结构示意图,与表示的意义一致的是
A.都属于阳离子: 、 、 |
B.都属于阴离子: 、 、 |
C.属于同种原子: 、 、 |
D.属于同种元素: 、 、 |
下列实验操作不当的是
| A.将烧碱放在已知质量的烧杯里用托盘天平称量 |
| B.将试管夹从试管底部往上套,夹在试管的中上部 |
| C.振荡试管时,用手紧握试管中下部,摆动手腕 |
| D.滴加浓氢氧化钠溶液时,滴管的伸入试管内且尖端触及干净的试管内壁 |
托盘天平调零后,在左盘衬纸上置氧化铜粉末,右盘衬纸上置1个5 g砝码,游码标尺示数如下,此时天平平衡。则被称量的氧化铜质量为
| A.8.3 g | B.7.7 g | C.3.3 g | D.2.7 g |
将“嫦娥”飞船送上月球的运载火箭在工作中发生的反应为:C2H8N2+2X=3N2+4H2O+2CO2,其 中X的化学式是
| A.N2O4 | B.NO | C.N2O3 | D.N2O5 |
下列化学用语与含义相符的是
| A.Na+:钠元素的化合价为+1价 | B.Mg2+:1个镁离子带2个单位正电荷 |
| C.NO2:2个二氧化氮分子 | D.2H:2个氢元素 |
下列说法错误的是
| 选项 |
甲 |
乙 |
| A |
常见碱 |
烧碱、熟石灰、纯碱 |
| B |
常见合金 |
生铁、不锈钢、青铜 |
| C |
常见干燥剂 |
浓硫酸、生石灰、氢氧化钠固体 |
| D |
常见营养物质 |
蛋白质、维生素、脂肪 |
下列关系中,正确的是
| A.pH:正常雨水<酸雨 |
| B.常温条件下在水中的溶解性:氢氧化钙>氢氧化钠 |
| C.等质量的木炭燃烧放出的热量:完全燃烧>不完全燃烧 |
| D.所有原子中:质子数=中子数 |
仅使用下列药品和仪器就可以制取的气体是 ( )
药品:稀硫酸、大理石、锌粒、高锰酸钾;
仪器:大试管、带导管的单孔橡皮塞、铁架台(带铁夹)、水槽、集气瓶、玻片。
| A.氢气、氧气、二氧化碳 | B.氢气、氧气 | C.二氧化碳、氢气 | D.氢气 |
下列符合质量守恒定律是
| A.木炭燃烧后变成灰烬,质量减少 |
| B.一定条件下,SO2和O2生成SO3,反应前后分子总数不变 |
| C.100g水加入100g酒精,成为总质量为200g的溶液 |
| D.8g H2完全燃烧生成8g H2O |
实验室的试剂常与空气中的一些成分作用而发生化学变化,下列对试剂在空气中发生变化的分析不正确的是
| A.铁粉生锈与空气中的水蒸气和氧气有关 |
| B.氢氧化钠潮解变质与空气中的水和二氧化碳有关 |
| C.浓盐酸变稀和空气中的水蒸气有关 |
| D.氧化钙的变质与空气中的水和二氧化碳有关 |
在学习化学的一年中,同学们所做了的教材上的八个基础实验,让同学们切身体会到规范操作的重要性。下列实验操作符合规范要求的是
| A.“探究碳酸钠的性质”实验中,测定溶液pH时应先将试纸湿润 |
| B.“粗盐的提纯”实验中,过滤时将悬浊液直接倒入漏斗里 |
| C.“配制一定溶质质量分数的溶液”实验中,多余的药品应放回原瓶 |
| D.“高锰酸钾制取氧气”实验中,收集好气体后应先将导管移出水槽再停止加热 |
下列物质能在pH=1的溶液中共存且形成的溶液为无色的是
| A.(NH4)2SO4、HCl、NaNO3、K2SO4、 | B.K2SO4、KNO3、H2SO4、KMnO4 |
| C.MgSO4、NaCl、HNO3、Na2CO3 | D.BaCl2、NaNO3、KCl、H2SO4 |
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每没种方案所用试剂如下,其中你认为不可行的是
| A.Cu、 Ag 、FeSO4溶液 | B.Fe 、Ag 、CuSO4溶液 |
| C.Fe 、Cu、AgNO3溶液、稀盐酸 | D.Cu 、FeSO4溶液、AgNO3溶液 |
汪逸凡同学对所学部分化学知识归纳如下,其中有错误的一组是
| A.生活中的物质 |
B.实验室 |
| 食盐的主要成分——氯化钠 大理石、石灰石的主要成分——碳酸钙 |
铁桶——硫酸铜溶液和石灰乳配制杀菌剂波尔多液 铝壶内的水垢——用质量分数为18%的盐酸长时间浸泡 |
| C.元素与人体健康 |
D.日常生活经验 |
| 缺铁——易引起贫血 缺碘——易患甲状腺肿大 |
区别老陈醋与酱油——闻气味 区分羊毛纤维与合成纤维——灼烧后闻气味 |
去年苏州地铁二号线开通,进一步实现高速铁路客运、公路长途客运、城市轨道交通、城市公交“零换乘”的现代化综合交通枢纽。建设过程中将使用大量的钢材、水泥等材料。下列有关说法不正确的是
| A.锰钢韧性好、硬度大可用于铺设铁轨的无机金属材料 |
| B.建设客站要使用大量的无机材料水泥 |
| C.车厢里的座椅采用的玻璃钢是无机非金属材料 |
| D.客站的有些门窗是塑料材料制成的,塑料属于合成材料 |
下面摘录了某些同学实验记录本中有关实验现象描述的一部分,其中正确的是
| A.将带有铜绿的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 |
| B.镁条在氧气中点燃,发出耀眼的强光,同时生成黑色固体 |
| C.红磷在氧气中燃烧,生成浓厚的白色烟雾 |
| D.将硫酸铜溶液滴加入到氢氧化钠溶液中,产生红褐色沉淀 |
下列鉴别物质的方法中,不切实可行的是
| A.用稀硫酸区分黄铜(Cu、Zn)和黄金 |
| B.用水鉴别氢氧化钠固体和碳酸钙固体 |
| C.用碳酸钠溶液鉴别氢氧化钙溶液和氯化钙溶液 |
| D.用尝区分厨房里的面粉和白糖 |
下列实验现象和对应的结论描述都正确的是
| A.在某固体中滴加稀盐酸,有气泡产生一一该固体一定是碳酸盐 |
| B.在无色溶液中滴入酚酞试液,溶液变红色——该溶液一定是碱溶液 |
| C.向饱和硫酸铵溶液中加入鸡蛋清,产生白色絮状沉淀——蛋白质变性 |
| D.生石灰块投入水中,水会沸腾——生石灰变成熟石灰的过程是放热反应 |
熟石灰的溶解度曲线如图所示。现将30℃时的1g熟石灰加入100g水中充分搅拌、过滤,不计溶液损失,再将得到的溶液降温到20℃.下列判断正确的是
| A.30℃时所得的溶液质量为101g |
| B.降温到20℃时溶质质量分数将变小 |
| C.向熟石灰溶液中滴加紫色石蕊试液,熟石灰变蓝色 |
| D.20℃时敞口静置一段时间后,则溶液表面会形成一层白膜。 |
20℃时,KNO3的溶解度为31.6g,向100g KNO3饱和溶液中再加5克KNO3晶体后,在温度不变的条件下,其溶液的溶质质量分数为
| A.27.6% | B.24.0% | C.31.6% | D.34.9% |
1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列论断:①一定含C、H;②一定不含O;③可能含O;④一定含O;⑤分子中C、H的原子个数比为1:2;⑥分子中C、H的原子个数比为1:4、其中正确的是
A.①④⑤ B.①②⑤ C.①③⑥ D.①②⑥
在下表栏目空格内,填写正确的名称、化学式、类别。
| 序号 |
(1) |
(2) |
(3) |
(4) |
(5) |
| 名称 |
|
水银 |
|
氨水 |
纯碱 |
| 化学式 |
H2SO3 |
|
FeO |
|
|
| 类别 |
酸 |
单质 |
氧化物 |
碱 |
|
现有下列变化:①镁加入到氯化铜溶液中;②双氧水中加入二氧化锰;③给水通直流电;④植物的光合作用;⑤用电热水壶给水加热.请回答下列问题:
(1)在上述变化中,属于其他形式的能量转化为化学能的是(填序号) ;
(2)现有下列选项:a.原子的数目;b.元素的种类;c.分子的种类;d.分子的数目;e.元素的化合价.在变化②中,不变的是(填序号) .
下列是酸、碱、盐的一些用途,写出相关的化学方程式:
(1)用含氢氧化铝的胃舒平治疗胃酸过多的患者: 。
(2)某些工厂用稀硫酸清洗铁制品表面的铁锈(主要成分氧化铁):
;溶液由无色变为 色。
(3)用烧碱溶液吸收工业废气中的SO2,以减少污染: ,该反应 (是不是)复分解反应。
(4)将少量硫酸铵晶体与熟石灰混合研磨: ;
研磨一段时间后,在研钵中可看到的现象是 。
(5)工业生产通过电解饱和食盐水得到烧碱、氯气、氢气:
。
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数。
(1) 恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数为多少?
(2)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示,那么a点对应的溶液中,在单位体积中微粒数目最多的是 (填写化学符号)。
(3)将b点对应的溶液放在蒸发皿中慢慢地蒸干,所得的固体中除了NaCl外,还可能含有__ ____ _(写化学式)
(8分)我市初三学生5月16日进行理化实验操作考核,其中一项是“配制50g 6%的氯化钠溶液”。该实验的部分操作如下图所示。

(1)需要称取氯化钠的质量是_ ___g,右边的托盘上需放左边的托盘相等质量的纸,其目的是 ;若称量时A出现了右盘略低的现象,接下来的具体操作是__________ 。
(2)量取水时,应选用规格为50mL的量筒而不选用100mL的量筒,其目的是 ;
(3)C中用玻璃棒搅拌的作用是________________________。
(4)D中所贴标签有不妥之处,并在方框中  写出你认为适合的内容。
写出你认为适合的内容。
(5)小明同学在实际操作中出现了如下操作,导致配制的氯化钠溶液质量分数偏小的有 ________________________。
| A.在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数; |
| B.氯化钠固体不纯; |
| C.量筒量取水前先用蒸馏水润洗; |
| D.将量筒中的水倒入烧杯时,有水洒出; |
E.按照图B的方法读数;
F.转移已配好的溶液时,有少量溶液洒落在瓶外
G.盛装溶液的试剂瓶留有少量蒸馏水
过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:【资料卡片】:
I、制备研究:下图是制备过碳酸钠的工艺流程。
请回答问题:
(1)操作A的名称是 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和 。
(2)生产中,反应及干燥均需在较低温度下进行,原因是 。
(3)加入较多的氯化钠的作用是 。
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。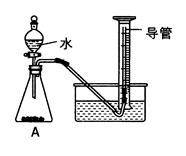
【实验步骤】:
①连接仪器,检查装置的气密性;
②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后
置于装置A中,在量筒中加满水;
③连接仪器,打开分液漏斗活塞,缓缓滴入水;
④待装置A中不再产生气泡时,停止加水,并关闭活塞;
⑤待量筒中水面不再变化时,记录其中水面刻度;
⑥根据数据进行计算。
【实验分析及数据处理】:
(4)实验中, ,则开始收集气体。
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(5)若量筒中收集到气体的体积是224mL(换算后质量约为0.32g),计算过碳酸钠样
品中2Na2CO3·3H2O2的质量分数为多少?[已知:Mr(2Na2CO3·3H2O2)=314,保留到0.1%
【反思】:
(6)量筒中长导管的作用是

 粤公网安备 44130202000953号
粤公网安备 44130202000953号