江苏省南京市中考第二次模拟化学试卷
下列过程中,主要发生物理变化的是
| A.大理石雕像受酸雨腐蚀 | B.镁条燃烧 |
| C.铜丝插入硝酸银溶液中 | D.蒸发食盐水 |
下面所列物质中,所贴警告标签错误的是
| 物质 |
浓盐酸 |
甲醛 |
乙醇 |
氢氧化钠 |
| 标签 |
 |
 |
 |
 |
| 选项 |
A |
B |
C |
D |
分类法是化学学习和研究的重要方法之一。下列分类正确的是
| A.非金属元素:Hg、O、Si | B.混合物:空气、石油、冰水共存物 |
| C.盐:KMnO4、NaNO2、CaCO3 | D.金属材料:生铁、玻璃钢、不锈钢 |
用下列药品完成对应的“家庭小实验”,不能达到预期目的的是 
| A.用柠檬酸、果汁、白糖、水、小苏打等制汽水 |
| B.用6B的铅笔芯和导线连接(右图)验证石墨的导电性 |
| C.用洗净的碎鸡蛋壳、食盐水制二氧化碳 |
| D.用酒精、紫卷心菜等自制酸碱指示剂 |
“瘦肉精” 学名盐酸克伦特罗, 化学式为C12H18Cl2N2O,食用含有“瘦肉精”的肉会对人体产生危害。下列关于瘦肉精说法正确的是
| A.瘦肉精中含有35个原子 | B.瘦肉精中碳元素的质量分数最大 |
| C.瘦肉精的相对分子质量277g | D.瘦肉精属于有机高分子化合物 |
下面是某学生对有关图表资料的应用,其中错误的是
| A.根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢 |
| B.根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行 |
| C.根据溶解度曲线图,选择从饱和溶液中获得某些晶体的方法 |
| D.根据相对原子质量表,判断原子内部结构 |
下列各组离子在溶液中一定能大量共存的是
| A.H+、OH-、HCO3- | B.Ca2+、OH-、CO32- |
| C.Ag+、NH4+、Cl- | D.Cu2+、NO3-、SO42- |
下列与化学有关的知识,完全正确的一组是
| A.常见物质的鉴别 |
B. 环境保护 |
| 羊毛和化纤——点燃后闻气味 磷矿粉和氯化铵——观察颜色 硬水和软水——加肥皂水搅拌 |
白色污染——只对人的视觉感观有影响 温室效应——对大气环境有影响 重金属污染——对人体内蛋白质有影响 |
| C. 化学与生活 |
D. 化学中常见的“三” |
| 汽油去油污与洗涤剂去油污——原理相同 蛋白质与油脂——组成元素相同 合金与纯金——硬度相同 |
H2、C、 CO2 ——三种具有还原性的物质 分子、原子、离子——三种构成物质的粒子 棉花、羊毛、天然橡胶——三大天然有机高分子材料 |
除去下列物质中的少量杂质,所选用的试剂和方法均正确的是
| 选项 |
物质(括号内为杂质) |
试剂 |
操作方法 |
| A |
CO2(CO) |
足量O2 |
点燃 |
| B |
CaO(CaCO3) |
适量稀盐酸 |
蒸发、结晶 |
| C |
NaNO3溶液(Na2SO4) |
适量碳酸钡固体 |
过滤 |
| D |
Cu粉(Fe粉) |
足量稀硫酸 |
过滤、洗涤、干燥 |
下图是KNO3、NaCl两种物质的溶解度曲线,下列说法中错误的是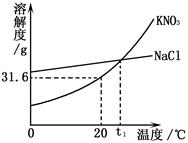
| A.t1℃时两物质的溶解度相等 |
B.20℃时KNO3饱和溶液溶质质量分数为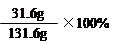 |
C.20℃时100g的KNO3饱和溶液中氧元素的质量为 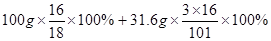 |
| D.欲从含有少量NaCl的饱和溶液中得到较多的KNO3,通 |
常可采用冷却热的饱和溶液的方法
下图中“—”表示相连的物质间在一定条件下可以发生反应,“→”表示甲在一定条件下可与某种物质直接反应生成丙。下表四组选项中,符合图中要求的是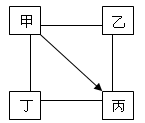
| |
甲 |
乙 |
丙 |
丁 |
| A |
BaCl2 |
CuSO4 |
Ba(OH)2 |
HCl |
| B |
O2 |
CO |
Fe3O4 |
C |
| C |
Fe |
CuCl2 |
Mg |
HCl |
| D |
Cu |
HCl |
CuO |
Mg |
某同学欲用蜡烛燃烧验证质量守恒定律,实验设计如下图所示。实验时用吸收剂将产生的水和二氧化碳进行彻底吸收。下列实验现象和分析错误的是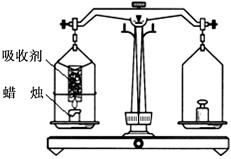
| A.点燃蜡烛后天平指针向右偏转 |
| B.蜡烛燃烧反应为氧化反应 |
| C.此实验中生成CO2中的碳元素质量一定等于 参加反应蜡烛中碳元素质量 |
| D.此实验中生成水中的氢元素质量一定等于参 |
加反应蜡烛中氢元素质量
身边处处有化学,请从下列4种物质中选择合适物质的序号填空:
| A.维生素C | B.盐酸 | C.尿素[CO(NH2)2 ] | D.苏打 |
(1)含氮量较高的常用氮肥 ; (2)可用于洗涤剂的是 ;
(3)除铁锈可选用 ; (4)常吃蔬菜水果可补充的是 。
下图是第三周期部分元素的微粒结构示意图,请根据题目要求填写下列空白。
(1)硫原子的质子数为 ,最外层电子数为 ,在化学反应中易得电子。
(2)当上图中x=0时,则该粒子结构示意图表示的是 ;(填粒子符号)
(3)由第三周期元素组成AB3型化合物,其化学式可能是 。
(4)上图中该周期元素原子的一条变化规律是 。
南京青奥会组委会承诺,保证2014年8月有一个“符合国际赛事标准的环境”。
(1)防止“雾霾围城”主要控制空气中 (填字母序号)的增加。
| A.二氧化碳 | B.一氧化碳 | C.二氧化硫 | D.可吸入颗粒物 |
(2)欲使燃料的充分燃烧通常考虑要有足够的空气和 ,化石燃料燃烧时排放出的 或其在空气中反应后的生成物溶于雨水,会形成酸雨。目前被认为是理想、清洁的高能燃料是 。
(3)下图是自然界碳、氧循环示意图。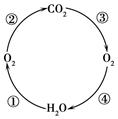
a. 图中③表示自然界中消耗二氧化碳的主要途径,其名称为 。
b. 按序号和规定的反应类型完成下列化学方程式
| 序号 |
反应类型 |
化学方程式 |
| ① |
分解反应 |
|
| ② |
化合反应 |
|
| ④ |
非基本反应类型 |
|
(8分)下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题: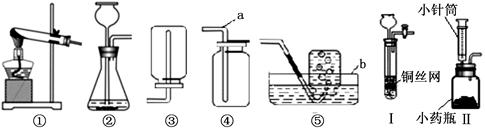
(1)写出图中编号仪器名称:a________、b_______
(2)利用上图所示装置,采用以下组合能完成实验室制取气体的是 。
| A.用①③制取氧气 | B.用②⑤制取氧气 |
| C.用②④制取二氧化碳 | D.用②⑤制取氢气 |
(3)若实验室用氯酸钾在装置①中制氧气,其反应的化学方程式为 。
(4)小波同学将装置②进行了改进,如图Ⅰ和Ⅱ。改进后的装置与②装置相比,装置Ⅰ的优点是 ;装置Ⅱ的优点是 ;实验室若用装置Ⅰ制取二氧化碳,铜网上常放置的药品应为 。
(4分)下图中的A~K分别代表初中化学中的常见物质。已知:G的浓溶液能使小木棍变黑,E、J为金属单质,K为蓝色不溶物,图中部分反应物或生成物及反应条件未标出。
请回答下列问题:
(1)G的化学式为 ,K的化学式为 。
(2)写出 J与I反应的化学方程式: ;
(7分)水是生命之源,爱护、珍惜水资源是每个公民的责任。
(1)自然界中的水不是纯水,可利用沉淀、 、吸附和蒸馏等方法可以净化水。
(2)水常用来配制各种溶液,下列物质溶于水后溶液温度明显升高的是 。
| A.氢氧化钠 | B.硝酸钾 | C.硝酸铵 | D.浓硫酸 |
(3)用浓硫酸配制100g 20%的稀硫酸的步骤:①混匀 ②计算 ③装瓶并贴标签 ④量取浓硫酸和水。其正确的顺序为 (填序号)。
(4)①热水瓶用久后,瓶胆内壁常附着一层水垢,试计算除去瓶胆内5g CaCO3,理论上需含5%醋酸的食醋的质量是多少?
[化学方程式为:CaCO3 + 2CH3COOH= (CH3COO)2 Ca + H2O + CO2↑]
(请写出解题过程)
②水垢主要成分是CaCO3、Mg(OH)2及一些不溶于酸的杂质,若除去5g此水垢,则加入食醋的质量(与①中数据比较)是 (填“增加、减少或不确定”)
(11分)实验设计中常通过放大、转化等方式使化学反应现象显现出来,从而达到实验目的。
【问题提出】怎样证明NaOH溶液与稀盐酸能发生化学反应?
【查阅资料】根据化学反应的本质:有新物质生成。可从两个方面设计实验证明:一是设计实验证明反应物的消失;二是设计实验证明有新物质生成。
【实验探究】方案一:在NaOH溶液中滴入几滴酚酞后再滴加盐酸,当观察到 时,即可确定二者发生了化学反应。其中和反应方程式为 。
方案二:在NaOH溶液滴加盐酸的过程中,用pH试纸不断测量溶液的酸碱度,当pH <7即可确定二者发生了化学反应。实验测得其图象如下图。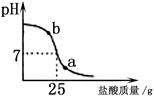
(1)测定pH的操作方法为 。
(2) b点表示溶液中的溶质是
(3)强调“pH <7时”作为判断的理由是
方案三:NaOH溶液与稀盐酸反应放热,若混合前后温度有变化,则证明发生了化学反应。某同学将不同溶质质量分数的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如表1)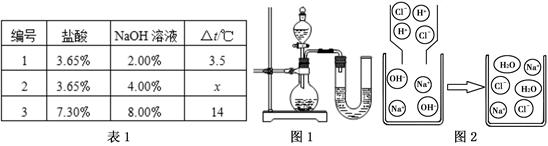
(1)表中x约为 。
(2)某同学在没使用温度计的情况下,通过图1所示装置完成了实验。则该同学根据 判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是 。
(3)对上述过程采用微观模型加以认识,如图2:当滴加盐酸过程中,氢氧化钠溶液中减少的离子是 (填离子符号)。
【拓展应用】下列几个方案中一定能证明CO2与NaOH溶液反应的是 。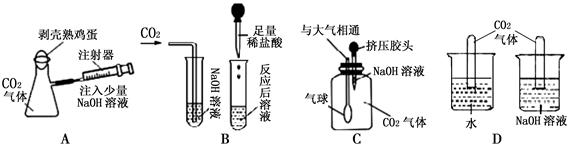
 粤公网安备 44130202000953号
粤公网安备 44130202000953号