广东省增城市初中毕业班综合测试化学试卷
利用下图所示的装置探究水的组成,有关电解水实验的叙述中,正确的是
| A.水是由氢元素和氧元素组成 |
| B.水由氢原子和氧原子构成 |
| C.电解水的过程中分子种类不变 |
| D.正极与负极产生的气体的体积比是1∶8 |
锌铬黄 (化学式为ZnCrO4)常用于制防锈涂料。锌铬黄中铬(Cr)元素的化合价为
| A.+1 | B.+2 | C.+6 | D.+7 |
下列说法中不正确的是
| A.涤纶属于天然纤维 | B.羊毛属于天然纤维 |
| C.羊毛主要成分为蛋白质 | D.燃烧方法可以区分羊毛和涤纶 |
下列实验操作中,正确的是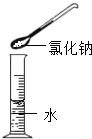
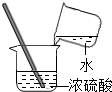
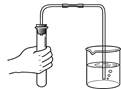
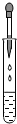
| A.配制氯化钠溶液 | B.稀释浓硫酸 | C.检查气密性 | D.往试管里滴加液体 |
下图是元素X的一种粒子结构示意图,下列说法正确的是
| A.X是稀有气体元素 |
| B.该粒子的质子数为10 |
| C.X与Mg形成的化合物为MgX2 |
| D.该粒子最外电子层已达到稳定结构 |
下列关于铁制品的使用合理的是
| A.用铁锅长期盛放姜醋 |
| B.不锈钢可用于制作外科手术刀 |
| C.在铁制容器中加入硫酸铜溶液和石灰水配制农药 |
| D.将生锈的菜刀浸泡在食盐水中除去其表面的铁锈 |
物质的性质决定物质的用途.下列各物质用途利用到物质化学性质的是
| A.氧气用于炼钢 | B.金属铜用来做导线 |
| C.用干冰进行人工降雨 | D.用活性炭除去水中的颜色和异味 |
煤气中加入有特殊气味的乙硫醇可提示煤气是否泄漏.乙硫醇(用X表示)
燃烧时发生的反应为:2X + 9O2点燃 4CO2 +2SO2 +6H2O , 则X 是
| A.C4H12S2 | B.C2H6 | C.C2H6O2 | D.C2H6S |
K2SO4是一种化学肥料,下列说法正确的是
| A.K2SO4属于复合肥料 |
| B.只观察外观,可以区别K2SO4 和磷矿粉 |
| C.K2SO4中钾、硫、氧三种元素的质量比为2:1:4 |
D.K2SO4中K元素的质量分数为 ×100% ×100% |
下列关于碳和碳的氧化物的说法中正确的是
| A.金刚石、石墨都具有良好的导电性 |
| B.CO2能将氧化铜还原成单质铜 |
| C.CO能与血液中的血红蛋白结合导致中毒 |
| D.可以用闻气味的方法来区别CO2和CO |
要使一杯pH=7的NaCl溶液变成pH=9,下列方法可行的是
| A.加入蒸馏水 | B.加入稀盐酸 | C.加入NaCl固体 | D.加入NaOH溶液 |
环境和能源是人类生存的基本条件,下列连线前后关系不正确的是

| A.过量排放CO2形成酸雨 | B.回收废弃塑料防止白色污染  |
C.发展氢能源开发清洁能源 | D.限制生产含磷洗衣粉减少水污染 |
下列宏观事实对应的微观解释中错误的是
| 选项 |
宏观事实 |
微观解释 |
| A |
非吸烟者受到被动吸烟的危害 |
分子在不断地运动 |
| B |
氧气在加压后变成液氧贮存在氧气罐中 |
分子间的间隔变小了 |
| C |
变瘪的乒乓球放入热水中后慢慢鼓起来 |
加热后分子体积变大 |
| D |
不同的花儿有不同的香味 |
不同种分子性质不同 |
下列有关与稀盐酸发生的化学变化中,不属于复分解反应的是
| A.HCl+ NaOH=NaCl + H2O | B.Fe + 2HCl = FeCl2 + H2↑ |
| C.HCl +AgNO3=AgCl↓+ HNO3 | D.2HCl + Na2CO3=2NaCl + H2O + CO2↑ |
有X、Y、Zn三种金属,它们之间能够发生如下反应:
X + Y(NO3)2 =" Y" + X(NO3)2 X + HCl= 不反应
则X、Y、Zn三种金属的活动性由强到弱的顺序是
| A.Zn、Y、X | B.Zn、X、Y | C.X、Y、Zn | D.X、Zn、Y |
下列设计的实验方案中不能达到目的的是
| A.用肥皂水区分硬水和软水 |
| B.用稀盐酸区分铁粉和木炭粉 |
| C.用酚酞溶液区分稀盐酸和食盐水 |
| D.在家里用尝味道的方法区分调味品食盐和蔗糖 |
控制变量法是实验探究的重要方法。下列四组对比实验获得的结论正确的是
| 选项 |
实验操作 |
结论 |
| A |
 |
呼出的气体全部都是CO2 |
| B |
 |
O2含量越高,反应越剧烈 |
| C |
 |
铁生锈一定有O2参与 |
| D |
 |
镁的活动性比锌强 |
(1)下列关于氢氧化钡性质的描述中,属于碱的共同性质的是
| A.能使紫色石蕊溶液变蓝色 | B.能与盐酸反应生成水 |
| C.能与Na2SO4溶液反应生成BaSO4沉淀 | D.能与CO2反应生成水 |
(2) 氢氧化钡与其它不同的碱表现出一些共同的性质,这是因为碱溶液中都含有 (用符号表示)。
(3)根据下图可以看出酸与碱发生中和反应的微观本质是 。
(4)请写出氢氧化钡与下列物质反应的化学方程式:
①与CO2反应: ;
②与CuCl2溶液反应: 。
下表为氯化钠、硝酸钾和氢氧化钙在不同温度下的溶解度。
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度 / g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
| Ca(OH)2 |
0.187 |
0.178 |
0.165 |
0.153 |
0.141 |
0.129 |
0.116 |
(1)从上表数据能获得的一条信息是 。
(2)20℃时分别往盛有100g水的烧杯中加入上述三种物质各35g,充分溶解后如图所示,则乙烧杯中的溶质是 。要使丙烧杯中的固体完全溶解,可采取的一种措施是 。
(3)在60℃时将100g水配成KNO3的饱和溶液,再将其降温至20℃所得溶液的质量为 。
(4)我们常用熟石灰中和污水中含有的硫酸,现有100 t含硫酸0.49%的废水,该废水含有硫酸的质量
是 t,完全处理这些废水需要氢氧化钙的质量是 t。
(1)常见的三大化石燃料是煤、石油、 。
(2)下列有关能量的叙述正确的是
| A.化学反应伴随着能量的变化 | B.化学反应过程中都会放出热量 |
| C.化学变化中只有燃烧反应才会放出热量 | D.人类需要的大部分能量是化学变化产生的 |
(3)家用罐装液化石油气的主要成分是丙烷、丁烷、丙烯、丁烯等。请写出丙烷(C3H8)完全燃烧的化学方程式 。
金属镍(Ni)与铁具有相似的化学性质。
(1)镍可形成化合价为+2和+3的两种氧化物,它们的化学式分别是 、 。
(2)氢氧化镍Ni(OH)2为强碱,请写出它与稀盐酸反应的化学方程式 。
(3)已知:正二价镍离子Ni2+显绿色。将金属镍投入稀盐酸中,发生反应的化学方程式为
Ni + 2HCl = NiCl2 + H2↑,则预测可观察到的现象是 ,
产生该现象的原因是溶液中 离子减少, 离子增加。
从铜、氧化铜的混合粉末中回收铜的具体流程如下:
回答下列问题:
(1)操作1是 。
(2)滤液Ⅰ中加入过量铁粉所发生的反应的化学方程式是
。
(3)试剂A的作用是 。
(4)此实验过程中,下列哪些做法会导致回收到的Cu不纯
A.往混合粉末中加入的稀H2SO4不足
B.往滤液Ⅰ中加入铁粉不足
C.往滤渣Ⅱ中加入试剂A不足
(5)请写出铜的一种用途: 。
(1)实验室测定溶液pH值,除了使用到pH试纸和白瓷板之外,还需要的仪器是_________
(2)过滤实验中,过滤后的液体浑浊,经检查发现滤纸破损,你应该要进行的处理是_______________。
6分)实验探究燃烧条件。
实验1 用棉花分别蘸酒精和水,在酒精灯火焰上加热片刻,
观察到蘸酒精的棉花燃烧而蘸水的棉花不燃烧。通过此实验说明
燃烧的条件之一是 。
实验2 如图进行实验,实验记录如下:
(1)白磷燃烧的化学方程式__________________________________;
(2)要得出“可燃物燃烧需要氧气”的结论,需要编号______和______的对比。
(3)若要使编号②铜片上的红磷燃烧,可采用的方法是_______________________________________。
| 编号 |
可燃物 |
现象(是否燃烧) |
影响因素 |
|
| 是否与氧气接触 |
温度是否达到着火点 |
|||
| ① |
铜片上的白磷 |
燃烧 |
√ |
√ |
| ② |
铜片上的红磷 |
不燃烧 |
√ |
× |
| ③ |
热水中的白磷 |
不燃烧 |
× |
√ |
(8分)下图是两套实验室制取气体的常用装置。
(1)制备CO2应选用的装置是 (填编号),生成CO2的化学方程式为 。
(2)B装置的气密性检查:先用止水夹夹住导管的橡皮管,然后向 中加入水至形成一段水柱,静置,若观察到 ,说明装置不漏气。
(3)集气瓶中气体的检验:往集气瓶里加入 ,振荡,
若 ,说明该气体是CO2。
(4)收集到一瓶二氧化碳后,按下图所示进行实验,观察到的现象是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号