福建省福州市高三5月综合练习理综化学试卷
在25℃、1×105Pa时,等质量的H2、Cl2、CO2、C2H2四种气体中( )
| A.H2分子数最大 | B.C2H2原子数最大 |
| C.CO2密度最大 | D.Cl2分子间平均距离最大 |
基于实验现象的推论,你认为合理的是( )
| 选项 |
实验现象 |
推论 |
| A |
乙烯气体可以使溴水褪色 |
乙烯发生取代反应 |
| B |
浓硫酸电导率比较低 |
硫酸浓度大时是弱电解质 |
| C |
氨气用于喷泉实验 |
氨气极易溶于水 |
| D |
硝酸溶液使pH试纸先变红后变白 |
硝酸酸性太强不能用pH试纸检测 |
对于相应化学用语的推论合理的是( )
| 选项 |
化学用语 |
推论 |
| A |
 U3+ U3+ |
该铀离子核外有89个电子 |
| B |
2H2(g)+O2(g)=" " 2H2O(g);△H=-483.6kJ•mol |
1mol氢气完全燃烧放出热量483.6kJ. |
| C |
2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
NaCl氧化性比Cl2强 |
| D |
FeO+4H++NO3―= Fe3++NO2↑+2H2O |
氧化亚铁溶于稀硝酸的离子方程式 |
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )

| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH4O + 3O2 = 2CO2↑+ 4H2O,下图是该燃料电池的示意图。下列说法错误的是( )
| A.燃料电池将化学能转化为电能 |
| B.a是甲醇、b是氧气 |
| C.质子从M电极区穿过交换膜移向N电极区 |
| D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+ |
常温下,向l00mL 0.01 mol•L-1盐酸中逐滴加入0.02 mol•L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol•L-1 |
四种主族元素的性质或结构信息如下:
| 元素编号 |
相关信息 |
| X |
地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y |
原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z |
同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M |
能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(1)M的原子结构示意图是 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式) (元素用元素符号表示,下同!)。
(2)Y单质溶于热浓的硫酸产生的气体的化学式为 。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式: 。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液 E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源 (填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是 。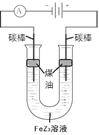
(15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是: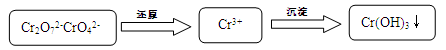
(1)加酸可以使CrO42-转化为Cr2O72-: 2CrO42- + 2H+ Cr2O72- + H2O
Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K= 。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为 。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol•L-1,溶液的pH应升高到 。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的 极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为 。往100.00mL 0.1000 mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图: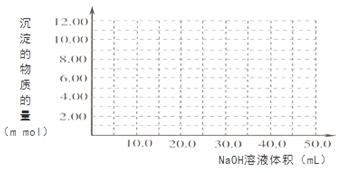
乙醇、乙酸都是有机化工重要的基础原料。
(1).空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为 。
(2).浓硫酸催化下,乙酸和乙醇生成乙酸乙酯

某化学兴趣小组的同学用以下装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是 。
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止 。
③相关物质的部分性质:
| |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点 |
78.0℃ |
117.9℃ |
77.5℃ |
| 水溶性 |
易溶 |
易溶 |
难溶 |
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由: 。④分离小试管中的乙酸乙酯应使用的仪器名称是 ;
⑤分离时,乙酸乙酯应该从仪器 (填“下口放” 或“上口倒出”)。
⑥兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如下表:
| 实验序号 |
乙醇(mL) |
乙酸(mL) |
乙酸乙酯(mL) |
| a |
2 |
2 |
1.33 |
| b |
3 |
2 |
1.57 |
| c |
4 |
2 |
X |
| d |
5 |
2 |
1.76 |
| e |
2 |
3 |
1.55 |
表中数据X的范围是 ;实验a与实验e探究的目的是 。
(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3•10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
(4)部分共价键键能数据如下表:
| 键 |
H-H |
N-H |
N-N |
N=N |
N≡N |
| 键能/kJ•mol-1 |
436 |
391 |
159 |
418 |
945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| |
分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(1).PET是应用广泛的五大工程塑料之一,PET结构片段:
①PET由两种有机物通过缩聚反应生成,其中分子较大的单体分子结构简式为 ,分子较小的单体含氧官能团名称是 。
②PET塑料有多种降解途径,其中常用的甲醇法是在一定条件下将其与过量的甲醇作用,降解为两种小分子。该反应的化学方程式为: 。
(2).水杨酸(邻羟基苯甲酸)是合成阿司匹林( )的原料。
)的原料。
①水杨酸与乙酸酐( )反应生成阿司匹林的化学方程式: 。
)反应生成阿司匹林的化学方程式: 。
②写出一种阿司匹林同分异构体的结构式 ,该同分异构体符合以下条件:
a.芳香族化合物;
b.与氢氧化钠溶液共热,完全反应将消耗四倍物质的量的氢氧化钠;
c.苯环上氢原子被一个溴原子取代,可能的产物有两种。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号