北京市通州区高考二模理综化学试卷
下列说法中,正确的是
| A.气象环境报告中新增的“PM2.5”是对一种新分子的描述 |
| B.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关 |
| C.小苏打是制作面包等糕点的膨松剂,苏打是治疗胃酸过多的一种药剂 |
| D.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
用下列装置进行相应实验,能达到实验目的的是
| A.用图1所示装置分离出溴苯 |
| B.用图2 所示装置制取干燥的氨气 |
| C.用图3设计成铜锌原电池装置 |
| D.用图4证明氢化物稳定性SiH4>CH4>H2S |
下列离子方程式正确的是
| A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4 |
B.亚硫酸氢钠溶液呈酸性:HSO +H2O +H2O H3O++SO H3O++SO |
| C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO =Ag++NO↑+H2O =Ag++NO↑+H2O |
下列有关化学概念或原理的论述中,正确的是
| A.任何一个氧化还原反应都可以设计为电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说
法正确的是
| X |
Y |
| Z |
W |
A.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应
下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol |
O2 反应放出115.6 kJ热量,键能如下表所示,则断裂1 mol
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实 验 操 作 |
实验现象 |
结 论 |
| A |
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 |
均有固体析出 |
蛋白质均发生变性 |
| B |
将一定量的NaNO3和KCl混合液加热浓缩至有固体析出,过滤 |
得到白色晶体 |
白色晶体为KNO3 |
| C |
向某FeCl2溶液中,加入Na2O2粉末 |
得红褐色沉淀 |
原FeCl2已氧化变质 |
| D |
向浓度均为0.1 mol/L NaCl和NaI混合溶液中滴加少量AgNO3溶液 |
出现黄色沉淀 |
Ksp(AgCl) > Ksp(AgI) |
有机物A是由C、H、O三种元素组成的五元环状化合物,其相对分子质量为98,其核磁共振氢谱只有1个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。G是一种合成橡胶和树脂的重要原料。已知:
① ② RCOOH RCH2OH(其中R是烃基)
RCH2OH(其中R是烃基)
有关物质的转化关系如下图所示,请回答以下问题:
(1)A中不含氧的官能团名称是 ;⑤的反应类型是 ;G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构);
(2)反应②的化学方程式为 ;
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物;E也可自身两分子发生反应生成一种六元环状化合物,写出这种环状化合物的结构简式 ;
(4)反应⑥的化学方程式为 ;
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简 式 。
下表为元素周期表的一部分:
 族 族周期 |
|
|
|
|||||
| 1 |
① |
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
② |
|
|
| 3 |
③ |
|
|
④ |
|
⑤ |
⑥ |
|
Ⅰ.用化学用语回答下列问题:
(1)写出元素④在周期表中的位置: ;
(2)②③⑤的原子半径由大到小的顺序为 ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化
合物的电子式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:
(1)写出固体A与液体X反应的离子方程式: ;
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知: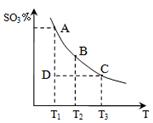
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
某兴趣小组的同学发现,将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。
Ⅰ.【提出猜想】
猜想1:所得沉淀为 ;
猜想2:所得沉淀为 ;
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2·nCuCO3]。
Ⅱ.【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
Ⅲ.【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;
Ⅳ.【问题讨论】
能证明猜想1成立的实验现象是 ;
(1)检查上述虚线框内装置气密性的实验操作是:关闭K, ;
(2)若在上述装置B中盛放无水CaCl2,C中盛放Ba(OH)2溶液,还可以测定所得沉淀的组成。
①C中盛放Ba(OH)2溶液,而不使用澄清石灰水的原因是 ;
②若所取蓝绿色固体质量为27.1 g,实验结束后,装置B的质量增加2.7 g,C中产生沉淀的质量为19.7 g 。则该蓝绿色固体的化学式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号