贵州省汇川区初中毕业生质量检测化学试卷
遵义地下水的硬度较大。日常生活中为了降低水的硬度,常采用的方法是
| A.加肥皂水 | B.煮沸 | C.蒸馏 | D.过滤 |
二氧化碳的下列用途只利用了其物理性质的是
| A.CO2用作光合作用的原料 | B.CO2用于灭火 |
| C.干冰用于人工降雨 | D.CO2用来制取Na2CO3 |
金银花含绿原酸(化学式为C16H18O9)有很高的药用价值。关于绿原酸的说法正确的是
| A.绿原酸属于混合物 | B.绿原酸中氢元素的质量分数最大 |
| C.绿原酸的相对分子质量为354g | D.绿原酸由碳、氢、氧三种元素组成 |
对于图示  ,理解错误的是
,理解错误的是
| A.原子可结合成分子 | B.可用 表示氢分子的形成过程 表示氢分子的形成过程 |
| C.物质都是由分子构成 | D.化学变化是分子的裂解和原子的重新组合 |
下列实验数据合理的是:①用托盘天平称取15.6gNaCl固体;②用pH试纸测得某溶液的pH为3.52;③用普通温度计测得某液体温度为25.62℃;④用10mL量筒量取6.6mL某溶液。
| A.①② | B.②③ | C.③④ | D.①④ |
对反应:X+H2SO4=BaSO4↓+2Y,下面分析正确的是
| A.Y中可能含有氢元素 | B.Y可能是HCl |
| C.X一定是BaCl2 | D.X和Y的相对分子质量之差一定为l35 |
往盛有稀硫酸的烧杯中加入足量的氧化铜粉末,充分反应后,再向烧杯中继续加入某种金属。实验过程中,烧杯中硫酸铜的质量随时间变化如下图所示(不考虑其他因素对烧杯中物质的影响)。下列判断错误的是
| A.从0到t3,烧杯中水的质量不断增加 |
| B.t1时与t2时烧杯中物质总质量相等 |
| C.加入的金属一定是银 |
| D.从t3到t4,硫酸铜质量变化可通过置换反应实现 |
碘元素是人体必需的微量元素之一。
(1)下图是元素周期表中碘元素的部分信息。碘原子的核电荷数是 ,
碘元素属于 (填“金属”或“非金属”)元素;
(2)已知某碘盐的主要成分为氯化钠和碘酸钾(KIO3)。
①氯化钠中含有的阴离子是 (用符号表示),KIO3中I的化合价为 价;
②用试剂X测定该碘盐中碘元素的含量,发生如下反应:
KIO3+5X+3H2SO4=3K2SO4+3I2+3H2O,推算X的化学式为 。
请根据要求填空:
(1)汽车尾气装置发生的反应是:2NO+2CO→N2+2CO2,该反应的基本类型是 ;
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 E.不属于上述中的一种 |
(2)DNA水解产物中的胸腺嘧啶(C3H6N2O2),该物质中氮元素与氧元素的质量比为 ;
(3)可燃冰的主要成分是甲烷(CH4),写出其燃烧的化学反应方程式 。
化学是以实验为基础的科学。根据所学知识,完成下列问题。
(1)实验A中标号为①的仪器名称是 ,实验A制取氧气发生的化学方程式为 ;
(2)实验B的操作是违规的,正确方法是 ;
(3)实验C中烧杯③的作用是 ;
(4)实验D中,气球的变化情况是先变大后变小,写出导致气球变小的化学方程式 。
金属材料在工业上有广泛的用途。
(1)铝合金材质与纯铝比较,主要优点是 ;
(2)钢铁的锈蚀主要是铁与空气中的 共同作用的结果,工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 ;
(3)为了避免钢铁腐蚀,通常在钢铁外壳上镶嵌比铁活动性强的金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图的两个实验:
①实验一,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 ;②实验二,若出现 现象,可证明铁的活动性强于铜,该反应的化学方程式为 。
硝酸钾是初中化学常见的一种物质。请按要求填空:
(1)质量分数为4.04%的硝酸钾(KNO3)溶液可作为无土栽培的营养液。该营养液 (填“属于”或“不属于”)复合肥;
(2)在硝酸钾溶液中,共有三种微粒,它们是K+、NO3-和 (用符号表示);
(3)黑火药爆炸的反应原理是:2KNO3+S+3C K2S+3CO2↑+N2↑,此反应的反应物和生成物中,没有涉及到下列物质类别中的 (填序号)
K2S+3CO2↑+N2↑,此反应的反应物和生成物中,没有涉及到下列物质类别中的 (填序号)
| A.单质 | B.氧化物 | C.酸 | D.碱 E.盐 |
(4)如右图,硝酸钾的溶解度随温度的升高而 ,50℃时,硝酸钾和氯化钠饱和溶液降温至20℃后,硝酸钾的溶质质量分数 氯化钠的溶质质量分数(填“﹥”、“﹦”或“﹤”),欲将接近饱和的 KNO3溶液变成饱和溶液,可采取的方法有 (列举一种)。
将V1mL3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的
NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和
温度变化(图3)。(实验中始终保持 V1+V2=50.0mL且各种溶液密度
均为1.0g/mL)。


(1)图2中V1="0" mL时,图1中烧杯内溶液的颜色显 色;
(2)实验中发生反应的化学方程式为 ;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1= mL;
(4)通过该实验给出的判断,其中正确的是 ;
| A.进行该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.该实验表明有水生成的反应都是放热反应 |
| D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱 |
(5)实验中所用NaOH溶液的溶质质量分数为 。
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(查阅资料:①氮气不与碳、氧化铁发生反应;②氢氧化钡易溶于水,氢氧化钙微溶于水。)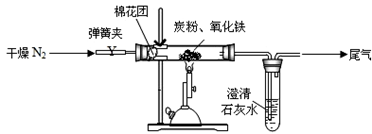
(1)[提出假设]①该反应的气体产物是CO2 ;②该反应的气体产物是CO;
③该反应的气体产物是 ;
(2)[设计方案]如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应。
(3)[实验步骤]①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气,目的是 ;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间氮气目的是 ,冷却至室温,称得硬质玻璃管和固体总质量为52.4g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
(4)[数据处理]根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
;
(5)[实验优化]A. 甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是:
① ;
②钡的相对原子质量较大,生成的沉淀质量较大,称量时误差较小;
B. 乙同学从环境保护的角度,提出一个优化方案是: 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号