高考名师推荐化学可充电池的反应规律
镁及其化合物一般无毒(或低毒)、无污染,且镁电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4。下列说法错误的是
MgxMo3S4。下列说法错误的是
| A.放电时Mg2+向正极迁移 |
B.放电时正极反应为Mo3S4+2xe-= |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为Mg2++2e-=Mg |
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
| A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2,下列有关说法正确的是
Li2O2,下列有关说法正确的是
| A.充电时,多孔金制成的电极外接电源负极 |
| B.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出 |
| C.放电时,Li+从负极向正极移动 |
| D.该电池可使用含Li+的水溶液作电解质溶液 |
Li/SO2电池具有输出功率高和低温性能好等特点,其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应式为2Li+2SO2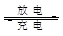 Li2S2O4。下列说法正确的是
Li2S2O4。下列说法正确的是
| A.该电池反应为可逆反应 |
| B.放电时,Li+向负极移动 |
| C.充电时,阴极反应式为Li++e-=Li |
| D.该电池的电解质溶液可以换成LiBr的水溶液 |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池。电池总反应为V2O4+xLi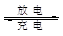 LixV2O4下列说法正确的是
LixV2O4下列说法正确的是
| A.该电池充电时锂极与外电源的负极相连 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+ |
| D.若放电时转移0.2 mol电子,则用去的锂为1.4x g |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn+O2=2ZnO,下列判断正确的是
| A.放电时,OH-向负极方向移动 |
| B.放电时,正极反应式为Zn+2OH--2e-=ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
| D.充电时,阴极反应为O2+2H2O+4e-=4OH- |
一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。该电池的电解质为6 mol·L-1 KOH溶液,下列说法中正确的是 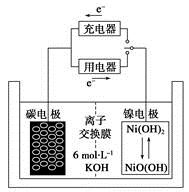
| A.充电时阴极发生氧化反应 |
| B.充电时将碳电极与电源的正极相连 |
| C.放电时碳电极反应为H2-2e-=2H+ |
| D.放电时镍电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。目前固体电解质在制造全固态电池及其他传感器、探测器等方面的应用日益广泛。如RbAg4I5晶体,其中迁移的物种全是Ag+,室温导电率达0.27 Ω-1·cm-1。利用RbAg4I5晶体,可以制成电化学气敏传感器。下图是一种测定O2含量的气体传感器示意图,被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是 
| A.I2+2Rb++2e-=2RbI | B.I2+2Ag++2e-=2AgI |
| C.Ag-e-=Ag+ | D.4AlI3+3O2=2Al2O3+6I2 |
一种光化学电池的结构如下图,当光照在表面涂有氯化银的银片上时, ,[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-—→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是
,[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-—→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是
| A.光照时,电流由Y流向X |
| B.光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 |
| C.光照时,Cl-向Ag电极移动 |
D.光照时,电池总反应为 |

 粤公网安备 44130202000953号
粤公网安备 44130202000953号