高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷
下列用品的有效成分及用途对应错误的是( )
| A |
B |
C |
D |
|
| 用品 |
 |
 |
 |
 |
| 有效成分 |
NaCl |
Na2CO3 |
Al(OH)3 |
Ca(ClO)2 |
| 用途 |
做调味品 |
做发酵粉 |
做抗酸药 |
做消毒剂 |
下列反应所得溶液中一定只含一种溶质的是 ( )
| A.向NaOH溶液中通入CO2 |
| B.向Ca(OH)2溶液中通入Cl2 |
| C.向蒸馏水中加入少量金属Na |
| D.向Al2(SO4)3溶液中滴入Ba(OH)2溶液 |
下列解释实验现象的反应方程式正确的是 ( )
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列与含氯化合物有关的说法正确的是 ( )
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
美国宇航局“凤凰”号火星登陆器的显微、电子化学及传导分析仪对两份土壤样本的分析发现,火星北极区表层土壤可能含有高氯酸盐,可创造不利于任何潜在生命的恶劣环境。则下列说法错误的是 ( )
| A.含有高氯酸盐的土壤不利于生命存在与高氯酸盐具有较强的氧化性有关 |
| B.当元素处于最高价态时一定具有强氧化性 |
| C.可以考虑用加入亚铁盐等还原性物质的方法改善这种土壤 |
| D.一定条件下高氯酸盐能与浓盐酸反应生成氯气 |
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O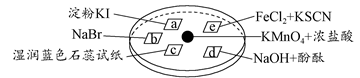
对实验现象的“解释或结论”正确的是( )
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl- |
亚硝酸钠(NaNO2)是一种常用的食品添加剂,具有防腐和增色作用。下列对亚硝酸钠性质的分析中,不合理的是( )
| A.亚硝酸钠中含有钠元素,焰色反应呈黄色 |
| B.已知亚硝酸为弱酸,则亚硝酸钠溶液呈碱性 |
| C.亚硝酸钠属于盐类物质,其水溶液能与金属钾反应生成金属钠 |
| D.亚硝酸钠中氮元素的化合价为+3,亚硝酸钠既具有氧化性又具有还原性 |
如图所示,四条直线分别表示钠、镁、铝、铁与足量Cl2反应时消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是( )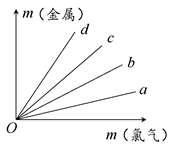
| A.a | B.b | C.c | D.d |
某种混合气体可能含有N2、HCl、CO、CO2,把混合气体依次通过足量的饱和NaHCO3溶液和灼热的氧化铜粉末,气体体积均没有明显变化;再通过足量的过氧化钠固体,气体体积减小;最后经过铜网,经充分反应后气体体积又减小了,但还有剩余气体。以下对该混合气体组成的判断正确的是( )
| A.一定没有N2和CO2,CO和HCl中至少有一种 |
| B.一定有N2、CO和HCl,一定没有CO2 |
| C.一定有N2,CO2、CO、HCl三者中至少有一种 |
| D.一定有N2和CO2,没有CO和HCl |
利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是( )
| A.非金属单质燃烧时火焰均为无色 |
| B.NaCl与Na2CO3灼烧时火焰颜色相同 |
| C.焰色反应均应透过蓝色钴玻璃观察 |
| D.只有金属单质灼烧时火焰才有颜色 |
下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤Cu与HNO3溶液反应,由于HNO3的浓度不同可发生不同的氧化还原反应
| A.都正确 | B.②③④⑤ | C.②③⑤ | D.④⑤ |
某溶液中含有0.005 mol FeBr2及其他物质,向该溶液中通入134.4 mL(标准状况)Cl2,溶液中只有FeBr2与Cl2反应,则通入Cl2后溶液中可能大量存在的离子是( )
| A.Fe2+、Fe3+、Br-、NO3- |
| B.Fe3+、H+、NO3-、K+ |
| C.Fe3+、Br-、NO3-、Cl- |
| D.Fe2+、Br-、NO3-、Cl- |
在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是( )
| A.pH增大,HClO浓度增大 | B.pH减小,Cl-浓度增大 |
| C.pH增大,Cl-浓度减小 | D.pH减小,HClO浓度减小 |
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2的体积(V)的关系如图所示,图中AB段发生反应的先后顺序是( )
①CO2+OH-=HCO3-
②CO2+2OH-=CO32-+H2O
③CO32-+Ba2+=BaCO3↓
④BaCO3+CO2+H2O=Ba2++2HCO3-
⑤CO32-+CO2+H2O=2HCO3-
⑥Ba2++2OH-+CO2=BaCO3↓+H2O
| A.②⑤ | B.⑤④⑥ | C.④② | D.④①⑥ |
NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.如图所示转化反应都是氧化还原反应 |
把一块镁铝合金投入到1 mol/L盐酸里,待合金完全溶解后,往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图A所示。下列说法中不正确的是( )
| A.a的取值范围为0≤a<50 |
B. 的最大值为2.5 的最大值为2.5 |
| C.若将关系图改为图B,则a的取值范围为80<a<90 |
| D.若将关系图改为图C,则a的取值范围为75<a<90 |
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为____________________________________。
(2)“趁热过滤”的原因是_______________________________________。
(3)若在实验室进行“趁热过滤”,可采用的措施是__________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_______________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取4份100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| A |
加AgNO3溶液 |
有白色沉淀生成 |
| B |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| C |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g |
| D |
加少量KMnO4酸性溶液 |
KMnO4溶液褪色 |
试回答下列问题:
(1)根据实验a判断Cl-是否存在________(填“一定存在”、“一定不存在”或“不能确定”)。
(2)该混合物中一定不存在的离子是_______________________________。
(3)①写出实验b中发生反应的离子方程式________。
②写出实验d中使KMnO4酸性溶液褪色的离子方程式________________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
| |
|
| |
|
| |
|
(5)混合物中是否存在K+?________,判断的理由是__________________。
实验室测定含碘废液中I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入10 mL 2 mol·L-1H2SO4,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250 mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,数据记录如下表:
(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
| 次数 |
1 |
2 |
3 |
| 滴定体积(mL) |
19.60 |
19.65 |
19.55 |
Ⅱ.碘的回收
取250 mL含碘废液于烧杯中加入按上述计算所需的Na2S2O3溶液,并将CuSO4饱和溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应(已知:2I-+2Cu2++2S2O32-=2CuI↓+S4O62-)。过滤,得到的沉淀按图1进行操作。检查装置的气密性后,从分液漏斗中逐滴加入浓硝酸(注意滴液的速度)完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液。然后按图2进行粗碘的提纯。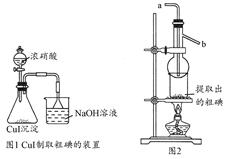
回答下列问题:
(1)用移液管量取废液时,将移液管竖直放入稍倾斜的锥形瓶中,接着的操作是______________________________________,数秒后,取出移液管。
(2)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是__________________________。
(3)根据滴定有关数据,该废液中I-含量是________g·L-1。
在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是_____。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(4)在图1锥形瓶中发生反应的化学方程式是____________________。
(5)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(选填a或b)接水龙头进水。最终得到较高纯度的单质碘。
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
_____________________________________________________________
②计算并确定该钠钾合金的化学式。
_____________________________________________________________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
_________________________________________________________________
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| |
氢氧化钠质量(g) |
氯化钠质量(g) |
| ① |
2.40 |
3.51 |
| ② |
2.32 |
2.34 |
| ③ |
3.48 |
3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号