高考化学二轮复习必做训练 化学能与热能练习卷
美国某技术公司开发出纳米级催化剂,可在较低温度下将甲烷转化成乙烯:2CH4(g)C2H4(g)+2H2(g) ΔH,已知在降低温度时该反应平衡向左移动,且有下列两个反应(Q1、Q2均为正值):
反应Ⅰ:C(s)+2H2(g)=CH4(g) ΔH1=-Q1
反应Ⅱ:C(s)+H2(g)=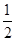 C2H4(g) ΔH2=-Q2
C2H4(g) ΔH2=-Q2
则下列判断正确的是( )
| A.ΔH<0 | B.Q2>Q1 | C.ΔH=2(Q1-Q2) | D.ΔH=Q1-Q2 |
下列说法或表示方法正确的是( )
| A.反应物的总能量低于生成物的总能量时,一定不能自发进行反应 |
B.已知:CH4(g)+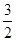 O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热 O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热 |
| C.恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)2C(g),充分反应后测得放出的热量为Q kJ,则该反应的ΔH=-Q kJ/mol |
| D.由4P(s,红磷)=P4(s,白磷) ΔH=+139.2 kJ/mol,可知红磷比白磷稳定 |
下列有关热化学方程式或反应热的说法正确的是( )
A.已知:H2(g)+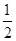 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)=SO2(g) ΔH1=-Q1;S(s)+O2(g)=SO2(g) ΔH2=-Q2(Q1、Q2均正值),则Q1<Q2 |
C.已知: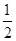 H2SO4(浓)+NaOH(aq)= H2SO4(浓)+NaOH(aq)=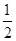 Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
D.已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1;CO(g)+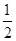 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 |
有关键能数据如表所示:
| 化学键 |
N≡N |
H—H |
H—N |
| 键能/kJ·mol-1 |
x |
436 |
391 |
已知N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol。则x的值为( )
A.945.6 B.649 C.431 D.869
已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
| A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0 |
| B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 |
| C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 |
| D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1 |
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |
已知下列热化学方程式:
Na+(g)+Cl-(g)=NaCl(s) ΔH
Na(s)+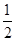 Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1
Na(s)=Na(g) ΔH2,Na(g)-e-=Na+(g) ΔH3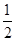 Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5的关系正确的是( )
| A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 |
| B.ΔH=ΔH1-ΔH2-ΔH3-ΔH4-ΔH5 |
| C.ΔH=ΔH1-ΔH2+ΔH3-ΔH4+ΔH5 |
| D.ΔH=ΔH2+ΔH3+ΔH4+ΔH5-ΔH1 |
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g)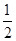 O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ·mol-1 |
| B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
| C.氢气的燃烧热为241.8 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1 |
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号