高考化学名师知识点精编 专题23实验方案的设计与评价练习卷
下列制备气体的实验设计中错误的是( )
| 选项 |
A |
B |
C |
D |
| 药品 |
NH4Cl 与Ca(OH)2 |
石灰石和 稀盐酸 |
稀硝酸 和铜片 |
KMnO4 与浓盐酸 |
| 装置 |
 |
 |
 |
 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
C.若A为浓硝酸,B为铜,C中盛KI 淀粉溶液,则C中溶液变蓝 淀粉溶液,则C中溶液变蓝 |
| D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用
于( )
| A.锌和盐酸生成氢气 |
| B.亚硫酸钠和浓硫酸生成二氧化硫 |
| C.碳酸钙和盐酸生成二氧化碳 |
| D.浓氨水和烧碱制取氨气 |
下列化学实验事实的描述及其结论都正确的是( )
| A.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性 |
| B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强 |
| C.FeCl3溶液可以腐蚀印刷电路板上的Cu,说明Fe的金属活动性大于Cu |
| D.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 |
下列实验装置不能达到实验目的的是( )

| A.甲装置电解精炼铝 |
| B.乙装置制备Fe(OH)2 |
| C.丙装置可得到金属铁 |
| D.丁装置验证NaHCO3和Na2CO3的热稳定性 |
某化学兴趣小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案一:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案二:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
| A.溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案二更便于实施 |
根据下列实验现象,所得结论正确的是( )

| 实验 |
实验现象 |
结论 |
| A |
左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
金属活动性:Al>Fe>Cu |
| B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl<AgBr<Ag2S |
| D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 硫的质量确定:
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50 mL 0.1 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
| 滴定次数 |
待测溶液 体积/mL |
草酸溶液体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.50 |
23.70 |
| 2 |
25.00 |
1.02 |
26.03 |
| 3 |
25.00 |
0.00 |
24.99 |
相关反应:①2Mn +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S +4H+
+4H+
②2Mn +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
【实验Ⅱ】 铁的质量确定:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是 。
(2)滴定终点的判断方法是 。
(3)试管C中品红溶液的作用是 。
有同学提出,撤去C装置,对实验没有影响,你的看法是 (选填“同意”或“不同意”),理由是 。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为 。
【问题探究】 滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
| 编号 |
温度/℃ |
酸化的H2C2O4 溶液/mL |
KMnO4 溶液/mL |
溶液褪 色时间/s |
| 1 |
25 |
5.0 |
2.0 |
40 |
| 2 |
25 |
5.0(另加少量可溶 于水的MnSO4粉末) |
2.0 |
4 |
| 3 |
60 |
5.0 |
2.0 |
25 |
(5)分析上述数据,滴定过程中反应速率较快的一种可能原因是 。
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。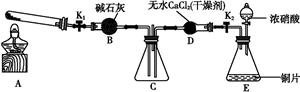
(1)E装置中制取NO2反应的化学方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
①装置的合理连接顺序是 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号