高考化学名师知识点精编 专题15富集在海水的元素—氯溴碘练习卷
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
B.2HCl+Ca(OH)2 CaCl2+2H2O CaCl2+2H2O |
C.5Cl2+I2+6H2O 10HCl+2HIO3 10HCl+2HIO3 |
D.2KClO3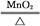 2KCl+3O2↑ 2KCl+3O2↑ |
在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( )
| A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在 |
| B.加入有色布条后,有色布条褪色,说明有HClO分子存在 |
| C.氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在 |
| D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
下列反应的离子方程式书写正确的是( )
A.在澄清石灰水中加入少量小苏打:Ca2++OH-+HC  CaCO3↓+H2O CaCO3↓+H2O |
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O 2C6H5OH+C 2C6H5OH+C |
C.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O S S +2HClO +2HClO |
D.将标准状况下112 mL氯气通入10 mL浓度为1 mol·L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2 2Fe3++6Cl-+2Br2 2Fe3++6Cl-+2Br2 |
下列能够检验出KI中是否含有Br-的实验是( )
| A.加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B.加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C.加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
从淡化海水中提取溴的流程如下:
淡化海水 低浓度 Br2
低浓度 Br2 含Br-等的溶液
含Br-等的溶液 Br2的浓溶液
Br2的浓溶液 液溴
液溴
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2 2Cl-+Br2
2Cl-+Br2
C工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
对下列事实的解释正确的是( )
| A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol |
| D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )

| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
以下进行性质比较的实验设计,不合理的是( )
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4 mol·L-1 NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器)。
(1)氯水需临时配制的原因是: (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。
(3)图乙所示装置中,瓶A 内的大试管上端管壁钻有一个小孔,瓶A的名称叫 ,该仪器通常用于
实验中(填基本实验操作的名称)。
(4)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。
分液漏斗中的盐酸应分数次加入试管内。若一次加入太多的盐酸,可能引起的后果是 。
(5)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是 。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N 氧化成I
氧化成I ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I 能被HS
能被HS 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 |
若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: |
若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: |
|
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号