高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 |
| B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C.第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 |
| D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新 |
下列有关物质的性质或结构的说法正确的是( )
| A.第二周期元素最高价与其原子最外层电子数相等 |
| B.Na的原子半径比Cl的大,但Na+的半径比Cl-的小 |
| C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱 |
| D.Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4 |
下列说法正确的是( )
| A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
下列有关物质的性质或结构的说法正确的是( )
| A.L层上的电子数为奇数的原子一定是主族元素的原子 |
| B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 |
| C.化学键的形成一定伴随着电子的转移和能量变化 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是( )
| J |
|
|
| |
|
R |
A.J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:
(1)设A、B、C、D四种元素的原子序数之和为m,则m 。
A.一定为奇数
B.一定为偶数
C.可能为奇数,也可能为偶数
(2)D元素原子的次外层电子数等于其他层电子数之和,则:
①写出A形成的简单离子的结构示意图 ,元素D位于元素周期表的第 族。
②A元素的一种氢化物分子中有6个原子,其结构简式为 。常压298 K时0.2 mol该气态氢化物在O2中完全燃烧,生成气态A单质和水,放出热量106.8 kJ,该气态氢化物燃烧的热化学方程式为 。
③写出C单质与B的最简单氢化物反应的化学方程式:
④实验证实AC3与水会发生反应生成HNO2和HF,则AC3和NaOH溶液反应的化学方程式为 。
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是( )
| |
|
X |
Y |
| Z |
W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X的氧化物不能与Z单质反应
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是( )
| A.原子半径:Y<Q<W |
| B.ZX3可使紫色石蕊溶液变蓝 |
| C.X、Z、Q 3种元素可组成离子化合物或共价化合物 |
| D.X2Q2、Y2X6 2种分子中含有的电子数、化学键种类都相同 |
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.主族元素原子的最外层电子数等于元素的最高正化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
下列判断错误的是( )
| A.沸点:NH3>PH3>AsH3 |
| B.熔点:Si3N4>NaCl>SiI4 |
| C.酸性:HClO4>H2SO4>H3PO4 |
| D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )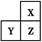
| A.原子半径:Y>Z>X |
| B.气态氢化物的热稳定性:X<Z |
| C.Y和Z的最高价氧化物对应水化物均为强酸 |
| D.若Z的最高正价为+m,则X的最高正价也一定为+m |
如图是元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。请回答下列问题:
(1)若X单质为空气的主要成分之一,则W原子结构示意图为 。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,则这两种离子的符号是 、 。
(3)若Na与Y和Z的单质分别反应可以生产摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为 ,所含化学键的类型为
(4)Y元素在周期表中可能处于第 纵行(写出所有可能纵行数)。
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp/25 ℃ |
2.0×10-16 |
4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号