[江苏]2014届江苏省南通市高三第一次调研测试化学试卷
2013年11月江苏在大部分地市推广使用含硫量大幅减少的苏V汽油。下列有关汽油的说法正确的是
A.汽油属于可再生能源 B.将原油通过萃取、分液可获得汽油
C.使用苏V汽油可降低酸雨发生率 D.苏V汽油只含C、H、O三种元素
下列有关化学用语表示正确的是
A.水的电子式: |
B.中子数为20的氯原子: |
C.聚丙烯的结构简式: |
D.钠原子的结构示意图: |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1盐酸的澄清透明溶液:Fe3+、K+、SO42-、Br- |
| B.含有NaNO3的溶液:H+、Fe2+、SO42-、Cl- |
| C.能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- |
| D.由水电离出的c(H+)·c(OH-)=10-22的溶液:Na+、Ca2+、HCO3-、NO3- |
下列有关物质性质或应用的说法正确的是
| A.医疗上,常用碳酸钠治疗胃酸过多 |
| B.在海轮外壳上安装锌块以减缓船体腐蚀 |
| C.液氨汽化放出大量的热,可用作制冷剂 |
| D.明矾具有强氧化性,常用于自来水的杀菌消毒 |
粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色反应等操作。下列图示对应的操作不规范的是
| A.称量 | B.溶解 | C.蒸发 | D.焰色反应 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如下图所示。下列有关物质的推断正确的是
| |
甲 |
乙 |
丙 |
丁 |
| A |
S |
SO2 |
SO3 |
O2 |
| B |
CO32— |
HCO3— |
CO2 |
H+ |
| C |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
| D |
Al3+ |
Al(OH)3 |
AlO2— |
NH3·H2O |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 mol·L-1的NaClO溶液中所含ClO-的数目为NA |
| B.标准状况下,2.24 L乙醇中含有的C—H数目为0.5NA |
| C.常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA |
| D.2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
下列表示对应化学反应的离子方程式正确的是
| A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O |
| C.向Na2SiO3溶液中通入过量CO2:SiO32-+ CO2 +H2O =H2SiO3↓+ CO32- |
| D.将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O |
1966年美国福特汽车公司首次发表了Na-S电池的有关报导。其结构如图所示,电池反应为2Na+ S8
S8 Na2Sn。下列说法不正确的是
Na2Sn。下列说法不正确的是
| A.熔钠电极作电池的正极 |
| B.放电时Na+向正极移动 |
| C.充电时熔钠电极与电源的负极相连 |
| D.充电时阳极反应式为8Sn2-—16e-=nS8 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
| |
|
|
|
|
|
X |
| Y |
|
Z |
|
|
|
W |
A.工业上电解ZW3饱和溶液冶炼金属Z
B.元素X的最高正价与W的最高正价相同
C.简单离子半径的大小顺序:r(Y+)>r(X—)
D.Y、W的最高价氧化物的水化物均能溶解金属Z
下列有关说法正确的是
A.氨水稀释后,溶液中 的值减小 的值减小 |
| B.0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0 |
化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下: +HCl
+HCl
下列有关叙述正确的是
| A.I的分子式为C9H10O4 |
| B.II中所有原子均有可能共面 |
| C.可用FeCl3溶液鉴别有机物I和III |
| D.1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5mol |
下列依据相关实验得出的结论正确的是
| A.用激光笔照射淀粉溶液和葡萄糖溶液,能产生光亮的“通路”的是淀粉溶液 |
| B.将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 |
| C.向某溶液中加入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl— |
| D.向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
一定温度下,卤化银AgX(X:Cl—、Br—、I—)及Ag2CrO4的沉淀溶解平衡曲线如图所示。横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“ -lgc(X-)”或“-lgc(CrO42—)”。下列说法正确的是
| A.a点表示c(Ag+)=c(CrO42—) |
| B.b点可表示AgI的饱和溶液 |
| C.该温度下AgI的Ksp约为1×10—16 |
| D.该温度下AgCl、AgBr饱和溶液中:c(Cl—)<c(Br—) |
一定条件下存在反应:2SO2(g)+O2 (g) 2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器I、Ⅲ中平衡常数相同 |
| B.容器II、Ⅲ中正反应速率相同 |
| C.容器Ⅱ、中的反应达平衡时,SO3的体积分数:II > III |
| D.容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 |
NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。实际工业生产中,可用硫磺、浓硫酸代替原料中的SO2,其原因为 (用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的: 。
(3)吸收器中生成NaClO2的离子反应方程式为 ,其中反应温度不能高于5℃的可能原因: 。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
①为除去过量的SO2,C中盛放的试剂为 。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为 、Na2O2+SO2= Na2SO4。
橙皮素具有抗氧化、消炎、降血脂、保护心血管和抗肿瘤等多种功效。它的合成路线如下:
(1)化合物A中的含氧官能团有 、 (填官能团名称)。
(2)已知:B→C为取代反应,其另一产物为HCl,写出X 的结构简式: 。
(3)反应D→E的反应类型是 。
(4)写出同时满足下列条件的B的同分异构体的结构简式: 。
Ⅰ.属于芳香族化合物;
Ⅱ.分子中有4种不同化学环境的氢;
Ⅲ.不能与FeCl3溶液发生显色反应,但能发生水解反应。
(5)已知:
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
WO3可用于制备电阻元件、电子射线屏等。其工业生产流程如下:
(1)操作X的目的是为了获得纯净的仲钨酸铵晶体,该操作包括:将用盐酸中和后的溶液 、冷却结晶、 、低温烘干。
(2)实际工业生产中,粗仲钨酸铵晶体(含少量NH4Cl晶体)可不经提纯就直接灼烧,其原因是 。
(3)已知:仲钨酸铵晶体[x(NH4)2O·yWO3·zH2O]受热分解的化学方程式如下:
x(NH4)2O·yWO3·zH2O→WO3 +NH3↑+H2O↑(未配平)。
某同学为测定仲钨酸铵晶体的组成,进行如下实验:
①准确称取16.21g样品,研细灼烧;
②将产生的气体通入装有碱石灰干燥管,充分吸收称得干燥管增重1.44g;
③称量冷却后的固体质量为13.92g。
通过计算确定此仲钨酸铵晶体的化学式(写出计算过程)。
葡萄糖酸锌[(C6H11O6O)2Zn]是一种营养锌强化剂,对婴儿及青少年的智力和身体发育有重要作用。工业上通过如下两步制备:
(1)步骤一:充分反应后,过滤除去CaSO4沉淀。设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42—: 。
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是 ,下列物质可替代ZnO的是 (填字母)。
a.NH3·H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的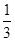 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Fe2+ |
5. 8 |
8. 8 |
| Cu2+ |
5. 2 |
6. 4 |
某研究性学习小组欲用粗制硫酸锌溶液(其中含有Fe2+、Cu2+等)制备出活性ZnO,然后再合成葡萄糖酸锌。实验室制备活性ZnO的步骤如下:
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至 (填写范围),除去溶液中Fe元素。
②加入 ,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液。
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生。写出该反应的离子方程式: 。
④过滤、洗涤,将沉淀灼烧得活性氧化锌。其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、 等。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=" +" 571.2 kJ・mol—1
BaS(s)= Ba(s)+S(s) △H=" +460" kJ・mol—1
已知:2C(s)+O2(g)=2CO(g) △H=" -221" kJ・mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①含硫物种B表示 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 (用离子方程式表示)。
(4)硫的有机物( )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
肉桂酸用途广泛,常被用作食品保鲜剂、食品添加剂、有机合成中间体等。其一种合成原理如下:
【实验步骤】
①向A中依次加入沸石、一定比例的苯甲醛、乙酸酐及少许碳酸钾。
②控制温度1500C~1700C,使其充分反应。
③向冷却后的三口瓶内加入饱和碳酸钠溶液,调节pH至9~10。
④如装置B所示,用水蒸气蒸馏,除去未反应的苯甲醛。
⑤加入活性炭,充分振荡并煮沸脱色。
⑥……
(1)装置A中冷凝管由 端(填“a”或“b”)通入冷凝水。
(2)步骤③中加入饱和碳酸钠溶液将肉桂酸、醋酸转化为肉桂酸钠和醋酸钠的原因: 。
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为 ,玻璃管的作用为 。
(4)当观察到冷凝管中 ,说明水蒸气蒸馏结束。
(5)步骤⑥通过以下操作分离、提纯得较纯净的肉桂酸(难溶于水),其正确的操作顺序是 (填字母)。
a.重结晶 b.冷却、抽滤,水洗晶体
c.加入浓盐酸调节pH=3 d.静置,趁热过滤得肉桂酸钠溶液
 粤公网安备 44130202000953号
粤公网安备 44130202000953号