2014年高考化学指导冲关 第11练化学实验基础知识练习卷
下列实验所用的试纸不能预先用蒸馏水湿润的是( )
| A.用品红试纸检验SO2 |
| B.用淀粉碘化钾试纸检验Cl2 |
| C.用红色石蕊试纸检验氨气 |
| D.用pH试纸测定某溶液的pH |
用下列实验装置进行相应实验,能达到实验目的的是( )

甲 乙 丙 丁
| A.装置甲:除去乙烯中混有的少量SO2 |
| B.装置乙:用浓硫酸配制1 mol/L的硫酸 |
| C.装置丙:检验HCl气体在水中的溶解性 |
| D.装置丁:用铜和浓硝酸反应制取NO2 |
下列实验能达到目的的是( )
| A.用CCl4萃取碘水中的碘 |
| B.将足量盐酸加入混有少量CaCO3杂质的Na2SO4中可除去杂质 |
| C.将混有少量HCl的Cl2通入NaOH溶液中除去HCl |
| D.将Fe(OH)3固体加入沸水中制备Fe(OH)3胶体 |
实验是化学研究的基础,关于下列各实验装置图的叙述中正确的是( )

① ② ③ ④
| A.装置①:常用于分离互不相溶的液体混合物 |
| B.装置②:可用于吸收NO2或HCl气体,并防止倒吸 |
| C.装置③:先从b口进气集满二氧化碳,再从a口进气,可收集一氧化氮 |
| D.装置④:可用来证明碳的非金属性比硅强 |
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
下列说法错误的是( )
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
某未知溶液中已检验出含大量的Fe2+、SO42—,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH4+、② SiO32—、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
| A.①③⑤ | B.②⑤⑥ | C.①②⑥ | D.③④⑥ |
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )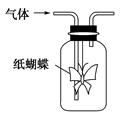
| |
A |
B |
C |
D |
| 喷洒液 |
酚酞 |
紫色石蕊 |
酸性重铬酸钾 |
酸化的KI—淀粉 |
| 通入的气体 |
NH3 |
Cl2 |
CH3CH2OH(g) |
O3 |
| 预测的颜色变化 |
变为红色 |
最终褪色 |
无明显变化 |
变为蓝色 |
用如图所示装置检验乙烯时不需要除杂的是( )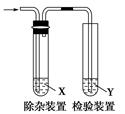
| |
乙烯的制备 |
试剂X |
试剂Y |
| A |
CH3CH2Br与NaOH乙醇溶液共热 |
H2O |
KMnO4酸性溶液 |
| B |
CH3CH2Br与NaOH乙醇溶液共热 |
H2O |
Br2的CCl4溶液 |
| C |
C2H5OH与浓H2SO4加热至170℃ |
NaOH溶液 |
KMnO4酸性溶液 |
| D |
C2H5OH与浓H2SO4加热至170℃ |
NaOH溶液 |
Br2的CCl4溶液 |
熟悉和使用中学化学实验中常见仪器及用途,是化学学习的基本要求。试回答下列问题。
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是________(填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶)
d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:
甲 乙 丙
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、________。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a―→____―→_____―→d(填接口代号)。
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。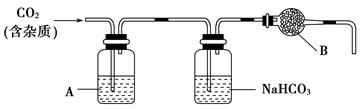
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________(填字母,下同)。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收________________。
(3)上述装置中,B物质是________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重。为了将石蜡和碳酸钙溶出,应选用的试剂是________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________。
(6)上述测定实验中,连续________,说明样品已经恒重。
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀的pH |
1.5 |
3.3 |
9.4 |
| 完全沉淀的pH |
3.7 |
5.2 |
11.0 |
实验步骤如下:
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3 C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
(1)洗涤滤渣A的目的是为了去除________(填离子符号),检验该离子是否洗净的方法是___________________________________________________。
(2)第②步反应的离子方程式是__________________________________,滤渣B的主要成分是________。
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点(铈被还原为Ce3+),消耗25.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号