[广东]2014届广东省深圳市直属六校高三第二次联考(2月)理综化学试卷
下列说法正确的是
| A.天然气、石油都是清洁的可再生能源 |
| B.在燃煤中添加碳酸钙或生石灰可以减少SO2的排放 |
| C.在AgC1饱和溶液中加入AgNO3溶液,达平衡时,溶液中Ksp(AgCl)降低 |
| D.地沟油和矿物油都属于酯类物质 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.室温下H2O2分解得到16 g O2,转移的电子数为2NA |
| B.含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为NA |
| C.标准状况下11.2 L CO和H2的混合气体完全燃烧消耗O2的量为0.25NA |
| D.相同物质的量OH-和CH3+含有相同数目的电子 |
下列离子方程式正确的是
| A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO- |
| B.硫酸镁溶液与氢氧化钡溶液混合:SO42- + Ba2+ =BaSO4↓ |
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.AlCl3溶液中加入过量氨水:Al3++3NH3•H2O =Al(OH)3↓+ 3NH4+ |
下列叙述正确的是
| A.图I装置中通入N2和O2的作用是相同的 |
| B.图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是
| A.X元素气态氢化物的水溶液不可能呈酸性 |
| B.X能形成化学式为NaXO3的含氧酸钠盐 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
浓H2SO4有吸水性 |
浓H2SO4可用于干燥氨气 |
| B |
SO2有还原性 |
SO2尾气可用NaOH溶液吸收 |
| C |
Mg有还原性 |
电解MgCl2饱和溶液可制备Mg |
| D |
锌金属活动性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
下列说法中,不正确的是
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
下列溶液中微粒浓度关系一定正确的是
| A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1 |
B.醋酸与醋酸钠的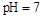 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
C.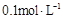 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-) |
已知:
Ⅴ由化合物Ⅲ合成:
请回答下列问题:
(1)化合物Ⅱ的分子式为 ,Ⅲ的含氧官能团的名称为 。
(2)反应①~③中,属于加成反应的是 ____________。
(3)化合物II与足量的H2(Ni作催化剂)加成后再在酸性条件下水解,所得产物之一可以发生聚合反应,写出该聚合产物的结构简式为:______________________________。
(4)1 mol化合物Ⅱ与C9H8的混合物完全燃烧时消耗O2的量为__________mol。
(5)化合物II与NaOH溶液能很快完全反应,写出该反应方程式: 。
(6)化合物II也能发生类似反应②的反应得到一种分子中含3个碳原子的有机物,该物质的结构简式为 。
(7)写出满足下列条件的IV的同分异构体的结构简式 。
①苯环上只有两个处于对位的取代基; ②能发生银镜反应;③核磁共振氢谱有5组吸收峰
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH= .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为: 

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为 。
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下: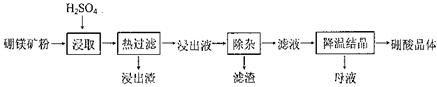
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、40. 2 g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)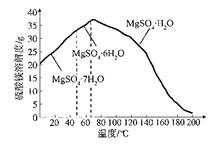
计算25℃时0.7mol·L-1硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10-7 K2=4.7×10-11 |
K=1.75×10-5 |
下列说法正确的是 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号