[安徽]2013-2014学年安徽省濉溪县高一上学期期末考试化学试卷
“纳米材料”是指粒子直径在几纳米到几十纳米的材料。若将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是
| A.能全部透过半透膜 | B.有丁达尔效应 |
| C.所得液体一定能导电 | D.所得物质一定为悬浊液或乳浊液 |
下列物质不能由单质直接化合而成的是
| A.NaCl | B.HCl | C.FeCl2 | D.Fe3O4 |
设NA为阿伏加德罗常数,下列叙述正确的是
| A.18g水中所含的电子数为8NA |
| B.11.2L氯气所含的分子数为0.5NA |
| C.2.4gMg与足量的盐酸反应失去的电子数为0.2NA |
| D.32g氧气中所含的氧原子数为NA |
下列关于实验操作能实现目的的是
 |
 |
 |
 |
| A.分离碘酒中的碘和酒精 |
B.实验室制氨气 |
C.除去Cl2中的HCl |
D.排水集气法收集NO |
下列储存药品的方法中,正确的是
| A.浓硫酸保存在橡胶塞试剂瓶中 |
| B.浓硝酸保存在无色试剂瓶中 |
| C.金属钠保存在煤油中 |
| D.氢氧化钠溶液保存在玻璃塞试剂瓶中 |
下列离子方程式中,正确的是
| A.稀硫酸滴在铁片上:2Fe + 6H+=2Fe3+ + 3H2 |
| B.氧化镁与稀盐酸混合:MgO + 2H+=Mg2+ + H2O |
| C.铜片插入硝酸银溶液中:Cu + Ag+=Cu2+ + Ag |
| D.氯气通人水中:Cl2+H2O=2H++Cl-+ Cl0- |
关于非金属元素Si、N、S、Cl的叙述,正确的是
| A.通常情况下,它们的单质均为气体 |
| B.它们在自然界中都存在游离态形式 |
| C.它们都有对应的含氧酸 |
| D.每种元素都只有一种氧化物 |
在无色透明溶液中,下列各组中的离子一定能大量共存的是
| A.K+、Fe2+、NO3-、H+ | B.Na+、Ca2+、Cl-、NO3- |
| C.Na+、H+、Cl-、HCO3- | D.Na+、Cu2+、OH-、SO42- |
在实验室中,对下列事故或药品的处理正确的是
| A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B.金属钠着火燃烧时,用泡沫灭火器灭火 |
| C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D.含硫酸的废液倒入水槽,用水冲入下水道 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液的浓度偏高的是
| A.溶液定容时俯视刻度线 |
| B.在空气中称量NaOH固体所用时间过长 |
| C.没有将洗涤液转移入容量瓶 |
| D.容量瓶洗涤后未作干燥处理即进行配制 |
向50 mL 18 mol·LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量是
| A.小于0.45 mol | B.等于0.45 mol |
| C.在0.45 mol和0.9 mol之间 | D.大于0.9 mol |
除去下列物质中少量杂质的方法正确的是
| A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气 |
| B.除去KCl溶液中混有的K2SO4:加入过量BaCl2溶液,过滤 |
| C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D.除去NaHCO3中混有的Na2CO3:用加热法 |
青花瓷让人赏心悦目,但其中所用的颜料一直是个迷,近年来科学家才得知大多数为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜的化合价为+2),下列关于硅酸铜钡的说法不正确的是
| A.可用氧化物的形式表示为BaO·CuO·2SiO2 |
| B.易溶于强酸和强碱 |
| C.性质稳定,不易脱色 |
| D.x=6 |
向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
A B C D
等质量的两种气体SO2和SO3,其物质的量之比为 ,二者所含O原子个数之比为 ,在同温同压下的体积之比为 。
下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其它成分未列出)
| 编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 名称 |
绿矾 |
醋精 |
苏打 |
酒精 |
铜导线 |
蔗糖 |
烧碱 |
| 主要 成分 |
FeSO4 |
CH3COOH |
Na2CO3 |
CH3CH2OH |
Cu |
C12H22O11 |
NaOH |
(1)请你对表中①~⑦的主要成分进行分类(填编号)
属于盐的是______________________,属于电解质的是_______________________,属于非电解质的是__________________________。
(2)写出过量盐酸与③反应的离子方程式为_______________________________________
化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中镁的总储量约为1.8×1015 t,海水里镁的存在形式主要是 。(填“游离态”或“化合态”)
②下列物质不经过化学变化就能从海水中获得的是 。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①工业上制造光导纤维的基本原料是 。
②下列物质中,不能用来制造耐火材料的是 。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
(3)保持洁净安全的生存环境已成为全人类的共识。
①pH< 的雨水称为酸雨。
②下列物质中,会破坏臭氧层的是 。(填字母)
A.氮气 B.一氧化碳 C.氟氯烃
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式: _________ 。
(2)收集氨气应使用 法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。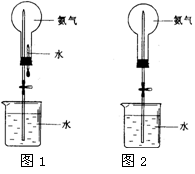
(5)如果只提供如图2的装置,请举例说明引发喷泉法 。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
。
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
(1)操作①的名称是 。
(2)沉淀A中含有的金属单质有 。
(3)操作②中在酸性下发生反应的离子方程式 。
(4)检验溶液B中含有的金属阳离子常用的试剂是 。
(5)操作③中发生反应的离子方程式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号