[陕西]2014届陕西省岐山县高三上学期期中质量检测化学试卷
做蒸馏实验时用到铁架台和单孔胶塞的个数分别为
| A.1个和2个 | B.2个和2个 | C.2个和3个 | D.2个和4个 |
将草酸(H2C2O4)晶体粗品经①加热溶解、②趁热过滤、③冷却结晶、④过滤洗涤、⑤干燥等实验步骤,得到较纯净的草酸晶体。该过程中除去粗品中溶解度较大的杂质是在
| A.步骤②的滤液中 | B.步骤③的晶体中 | C.步骤④的滤液中 | D.步骤④的滤纸上 |
下列各组物质相互作用时,其中水既不作氧化剂,又不作还原剂,而反应仍属于氧化还原反应的是
| A.氟与水反应 | B.Na与水反应 | C.铝与强碱液作用 | D.过氧化钠与水反应 |
下列变化一定属于化学变化的是
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色 ⑧分馏 ⑨NO2气体冷却后颜色变浅 ⑩潮解
| A.①②③④⑦ | B.③④⑤⑦ | C.①③④⑦⑩ | D.①③⑤⑦⑨ |
烧杯中盛有液态物质A,加入少量固体物质B,B不溶解。当通入气体C时发现B逐渐溶解直至完全溶解。则A、B、C依次为
A.H2O、BaSO4、O2 B.FeCl2溶液、Fe粉、Cl2
C.H2O、CaCO3、SO3气体 D.H2O、SiO2、HCl气体
下列叙述正确的是
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑥标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解
| A.①②④ | B.①③⑤ | C.②③⑥ | D.②④⑤ |
现有两种金属的混合物共4克,与足量氯气反应后,固体增重7.1克。另取4克该金属混合物,投入到足量盐酸中,产生2.24L(标准状况)H2。则该混合物的组成不可能是
①Cu,Al ②Mg,Fe ③Zn,Al ④Mg,Zn
| A.①② | B.③④ | C.①③ | D.②④ |
下列离子方程式书写正确的是
| A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH‾ |
| B.向Al2(SO4)3溶液中加入过量的氨水:Al++4NH3·H2O=AlO2‾+4NH4++2H2O |
| C.向海带灰浸出液中加入硫酸、双氧水:2I‾+2H++H2O2=I2+2H2O |
| D.向氢氧化钡溶液中加入过量的碳酸氢钠溶液:Ba2++HCO3‾+OH‾=BaCO3↓+H2O |
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中滴入NaHCO3溶液
⑤向饱和Na2CO3溶液中通入足量CO2 ⑥氯化钙溶液中通入少量的CO2
| A.①③④⑤ | B.只有①④ | C.只有②③⑥ | D.只有③④⑤ |
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
| A.①⑥⑤③ | B.②③④③ | C.②③⑤③ | D.①③⑤③ |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,17 g甲基(—14CH3)所含的中子数为9NA
②常温常压下,22.4 L NO气体的分子数小于NA
③56 g铁与16g硫充分反应,失去2NA个电子
④常温常压下,100 mL 0.5 mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况下,22.4 L二氯甲烷所含有的分子数为NA
⑥常温常压下,1 mol氦气含有的核外电子数为4NA
⑦1mol/LNaCl溶液表示1L水中含有NaCl 58.5g
⑧1molO2与足量金属钠反应,得到了4mol e‾
⑨不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半
⑩1 mol Na2O2晶体中含有阴离子总数为NA
| A.①②⑧ | B.③④⑨ | C.②④⑩ | D.⑤⑥⑦ |
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH‾
②pH=ll的溶液中:CO32‾、Na+、AlO2‾、NO3‾
③加入Al能放出H2的溶液中:Cl‾、HCO3‾、SO42‾、NH4+
④由水电离出的c(OH‾)=10‾13mol·L‾1的溶液中:Na+、Ba2+、Cl‾、Br‾
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN‾、HCO3‾
⑥酸性溶液中:Fe2+、Al3+、NO3‾、I‾、Cl‾
| A.①② | B.③⑥ | C.②④ | D.③⑤ |
下列说法正确的是
| A.高纯度的硅单质广泛用于制作光导纤维 |
| B.化工生产时将氯气通入到饱和的石灰水中可制得大量漂粉精 |
| C.SO2被氧气氧化的条件一般选择高温、高压、催化剂 |
| D.矿青石棉的化学式为:Na2Fe5Si8O22(OH)2改写成氧化物的形式则为Na2O·3FeO·Fe2O3·8SiO2·H2O |
钴(Co)的氧化物是一种重要的化工原料,工业上利用CoCO3+O2→CoxOy+ CO2反应来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。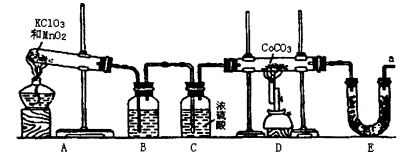
请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式 ;
(2)E装置的U形管里盛放的物质是 ;
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCI溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起 ;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为 ;
(6)此实验装置存在一个比较大的缺陷,如何完善 。
(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔:
H.静置、分层。就此实验,完成下列填空:
正确操作步骤的顺序是: 。
(2)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82‾+H2O—MnO4‾+SO42‾+H+
该反应常用于检验Mn2+的存在。其特征现象是 。
若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目:
②上述反应中还原产物是
六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3、⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,她能成功吗? (填“能”或“不能”)。
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ,有一组在混合时.随着试剂滴加后的时间不同而出现明显不同的现象,该组是为 ,该组涉及氧化还原应的化学方程式 。
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
(4)以下各种溶液不用任何外加试剂,就能实现鉴别的是
①Al(NO3)3 FeCl3 NaOH FeSO4 NaHCO3
②Na2CO3 BaCl2 AgNO3 Na2SO4 NH3·H2O
③KOH NaCl NaHCO3 MgSO4 KNO3
④CuSO4 KHSO4 NaHCO3 KOH
⑤NaAlO2 Na2SiO3 Na2CO3 NaHSO4 NaCl
⑥NH4Cl Na2SO4 (NH4)2SO4 Ba(OH)2 AlCl3
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。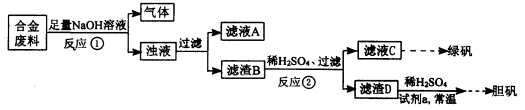
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 |
① |
② |
③ |
④ |
| 稀HNO3体积(mL) |
100 |
200 |
300 |
400 |
| 剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
| NO体积(L,标况) |
1.12 |
2.24 |
3.36 |
4.48 |
①实验①最先溶解的金属发生反应的化学方程式是 。
②滤渣B中Fe的质量分数为____%(精确到0.1%)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号