2014届东北三省四市教研协作体高三联合考试理综化学试卷
下列说法正确的是
| A.糖类、油脂、蛋白质在一定条件都能发生水解反应 |
| B.苯只能发生取代反应,不能发生加成反应 |
| C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D.溴乙烷与NaOH的乙醇溶液共热生成乙烯 |
下列各组物质中,物质之间不能通过一步反应就能实现图示变化的是
| 选项 |
物质转化关系 |
a |
b |
c |
d |
| A |
 |
FeCl2s |
FeCl3s |
Fe |
CuCl2 |
| B |
NO |
NO2 |
N2 |
HNO3 |
|
| C |
Na2CO3 |
NaOH |
Na2O2 |
NaHCO3 |
|
| D |
Al2O3 |
NaAlO2 |
Al |
Al(OH)3 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.2.3g金属钠与过量的氧气反应,无论是否加热与否转移电子数均为0.1NA |
| B.1mol Na2CO3晶体中含CO32-离子数小于NA |
| C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2L |
| D.0.1mol的CaO2中含阴离子数是0.2 NA |
下列各示意图与对应的表述正确的是
| A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应 |
| B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图 |
| C.图③表示等体积、等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的物质的量的变化 |
| D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
下列离子方程式表达正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
B.小苏打溶液呈碱性的原因:HCO3-+H2O H3O++CO32- H3O++CO32- |
| C.溴化亚铁溶液中通入足量氯气:2Fe2++ 4Br-+ 3Cl2 = 2Fe3++2 Br2 + 6Cl- |
| D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼 雷电池,其原理如图所示。该电池的负极反应式是 
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。
判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
(3)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
[化学-选修化学与技术]
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
| A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道 |
| C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①H3BO3中B的原子杂化类型为 ;
②写出硼酸在水溶液中的电离方程式 。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)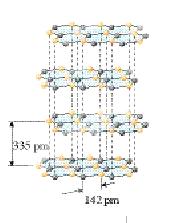
A~J及X均为有机化合物,它们之间的转化如下图所示:
 实验表明:①X的分子结构中无支链,链状二烯烃,D既能发生银镜反应,又能与金属钠反应放出氢气:
实验表明:①X的分子结构中无支链,链状二烯烃,D既能发生银镜反应,又能与金属钠反应放出氢气:
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)X的结构简式为____________(不考虑立体结构),由X生成A的反应类型是____________反应;
(2)D的结构简式为_____________;
(3)由E生成F的化学方程式为_______________, E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(4)G的结构简式为_____________________;
(5)由I生成J的化学方程式______________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号