[湖北]2013-2014学年湖北省襄阳市四校高一上学期期中考试化学试卷
根据气象台报道,近年每到春季,沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的( )
| A.胶体 | B.悬浊液 | C.乳浊液 | D.溶液 |
下列物质分类正确的是( )
| A.Cu(OH)2难溶于水,属于非电解质 |
| B.SO2能与碱反应生成盐和水,属于酸性氧化物 |
| C.NH4Cl组成中不含金属离子,不属于盐 |
| D.金属铝易导电,属于电解质并且属于强电解质 |
下列实验操作中正确的是( )
| A.蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸 |
| B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C.蒸发操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
在无色透明的酸性溶液中,能大量共存的离子组是( )
| A.Na+、Ag+、S2-、SO42- | B.Mg2+、NH4+、NO3- 、Cl- |
| C.Na+、K + 、SO32-、CH3COO- | D.Cu2+、Na+、NO3-、SO42- |
在Na2SO4、NaCl、NaOH的混合溶液中,Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
| A.1:1:1 | B.1:4:2 | C.1:2:4 | D.1:3:2 |
| |
X |
Y |
Z |
| A |
氧化物 |
化合物 |
纯净物 |
| B |
胶体 |
分散系 |
混合物 |
| C |
电解质 |
酸、碱、盐 |
化合物 |
| D |
碱性氧化物 |
金属氧化物 |
氧化物 |
用下图表示的一些物质或概念间的从属关系中不正确的是( )
| A.苯的同系物芳香烃芳香族化合物 |
| B.胶体分散系混合物 |
| C.电解质离子化合物化合物 |
| D.碱性氧化物金属氧化物氧化物 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.2.4g镁原子变成离子时,失去的电子数为0.3NA |
| B.常温常压下,28g氮气所含的原子数为2 NA |
| C.22.4L甲烷(CH4)所含的原子数为5NA |
| D.物质的量浓度为0.5mol / L的MgCl2溶液中,含有Cl—个数为1 NA |
复印机工作时产生臭氧,臭氧的浓度过高时对人体有害。臭氧可使湿润的淀粉碘化钾试
纸变蓝,反应为:2KI+O3+H2O=2KOH+I2+O2,下列结论正确的是( )
| A.O3在反应中被氧化为O2 | B.1molO3在反应中得到6mol电子 |
| C.KI在反应中被还原为I2 | D.KI在反应中被氧化为I2 |
能用H+ + OH- =H2O来表示的化学反应是( )
| A.氢氧化镁和稀盐酸反应 | B.Ba(OH)2溶液滴入稀硫酸中 |
| C.硫酸与氨水混合 | D.澄清石灰水和稀硝酸反应 |
实验室需配制一种c (H+)=2mol/L的强酸溶液500mL,下列配制方法可行的是( )
| A.取100mL5mol/LH2SO4,加入400mL水 |
| B.取200mL5mol/LHCl,加水稀释至500mL |
| C.取200 mL5mol/LH2SO4,加水稀释至500mL |
| D.取100 mL5mol/LHNO3,加水稀释至500mL |
同温同压下,等质量的SO2气体和SO3气体相比较,下列叙述中正确的是( )
| A.密度比为4:5 | B.物质的量之比为4:5 |
| C.体积比为1:1 | D.原子数之比为3:4 |
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O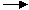 Y+H2
Y+H2 ↑;Z+H2O
↑;Z+H2O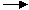 W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
| A.X>Y Z>W | B.X<Y Z<W |
| C.X>Y Z<W | D.X<Y Z>W |
以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的( )
| A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1 |
| B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等 |
| C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 |
| D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n |
除去NaCl中混有的 MgCl2、Na2SO4时选用试剂依次为( )
| A.NaOH、BaCl2、Na2CO3、HCl |
| B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl |
| C.NaOH、Ba(NO3) 2、Na2CO3、HCl |
| D.Na2CO3、BaCl2、HCl |
M2O7x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是(填化学式) 。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式 、 。
根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 回答下列问题:
(1)氧化剂是 ,氧化产物是 。
(2)氧化剂与氧化产物的物质的量比是 。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,反应中转移的电子数为 ;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
下面是几种实验中常用的仪器:
A.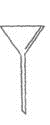 B.
B.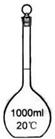 C.
C.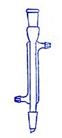 D.
D.
(1)写出序号所代表的仪器的名称:B___________;C___________;D___________
实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是_______________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②“定容”
③待冷却至室温后,将溶液转移到500 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液转移到容量瓶中。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
(5)写出步骤②“定容”的具体操作:
(6)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。某学生课
外活动小组欲从海藻中提取碘,设计如下的流程:
(已知过程②中反应的离子方程式为:2I- + Cl2 = 2Cl- + I2)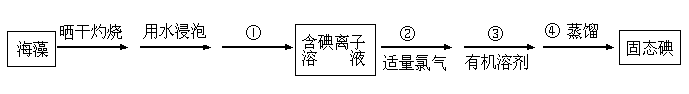
Ⅰ.指出提取碘的过程中有关的实验操作的名称:① , ③ 。
Ⅱ.提取碘的过程中,可选择的有机溶剂是 (填序号) 。
A、酒精 B、醋酸 C 、四氯化碳
有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
① 将固体混合物溶于水中,搅拌后得无色透明溶液;
② 往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③ 过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是 ,一定不含有的物质是 ,(均填化学式)。对可能含有的物质,可采用向滤液中滴加 溶液的方法来检验。
(2)写出步骤③中的离子方程式 。
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号