[上海]2014届上海市浦东新区高三上学期期中考试化学试卷
化学与生产、生活密切相关。下列叙述错误的是
| A.热的纯碱溶液可用于洗涤物品表面油污 |
| B.药皂中加入苯酚,可以起到杀菌消毒的作用 |
| C.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| D.假酒会对人体造成伤害,有毒成分主要是甲醇 |
下列化学用语正确的是
A.羟基的电子式: |
B.核内有10个中子的氧原子: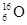 |
| C.乙醛的结构简式:CH3COH |
D.碳原子的轨道表示式: |
据报道,用10B合成的10B20有较好的抗癌作用。下列叙述正确的是
| A.10B20是一种新型化合物 | B.10B的中子数和核外电子数相等 |
| C.10B20晶体熔点高,硬度大 | D.10B和10B20互为同位素 |
下列现象能用键能大小解释的是
| A.稀有气体一般很难发生化学反应 | B.常温常压下,溴呈液态 |
| C.氮气的化学性质比氧气稳定 | D.硝酸容易挥发,而硫酸很难挥发 |
“地沟油”是指在生活中存在的各类劣质油脂,下列将“地沟油”变废为宝的各种方案中一定不能实现的是
| A.发酵生产乙醇、沼气 | B.分馏获得汽油、煤油 |
| C.水解制造肥皂、甘油 | D.转化成工业润滑油 |
元素性质的周期性变化不包括
| A.原子半径 | B.元素的主要化合价 |
| C.原子核外电子结构 | D.金属性和非金属性 |
有关晶体的下列说法中正确的是
| A.晶体中分子间作用力越大,分子越稳定 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰熔化时水分子中共价键发生断裂 |
| D.氯化钠熔化时离子键未被破坏 |
下列各组物质的性质比较中,正确的是
| A.热稳定性:H2O>HF>H2S | B.沸点:HF>HCl>HBr |
| C.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl | D.氧化性:Fe3+>Cu2+>H+ |
五颜六色的变化增添了化学的魅力。下列有关反应的颜色变化叙述:
①新制氯水久置后→无色;②淀粉溶液遇单质碘→蓝色;③溴化银见光分解→银白色;④热的氧化铜遇乙醇→红色;⑤硝酸银溶液和碘化钾溶液产生沉淀→黄色;⑥苯酚在空气中被氧化→粉红色。其中正确的是
| A.①②④⑤⑥ | B.②③④⑤⑥ | C.①②③④⑤ | D.①④⑤⑥ |
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是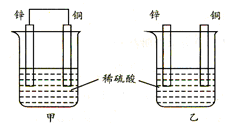
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+ |
| C.两烧杯中的pH值均增大 |
| D.产生的气泡速率甲比乙慢 |
为了除去括号中的杂质,采用的试剂和方法均为正确的是
| 选项 |
物质 |
加入试剂 |
方法 |
| A. |
甲苯(苯酚) |
浓溴水 |
过滤 |
| B. |
溴乙烷(溴单质) |
热氢氧化钠溶液 |
分液 |
| C. |
乙酸乙酯(乙酸) |
饱和碳酸钠 |
过滤 |
| D. |
NaOH(s)(少量NaCl) |
水 |
重结晶 |
已知:乙醇可被强氧化剂氧化为乙酸。BrCH2CH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是
| A.水解反应、加成反应、氧化反应 | B.加成反应、水解反应、氧化反应 |
| C.水解反应、氧化反应、加成反应 | D.加成反应、氧化反应、水解反应 |
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
| A.少量Na2SO4固体,v(H2)减小 | B.VmLBaCl2溶液,v(H2)不变 |
| C.加入细小的碳粒,v(H2)增大 | D.加入NH4HSO4固体,v(H2)不变 |
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病。其转化过程如下:
下列说法错误的是
| A.1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 |
| B.酪氨酸能发生加成、取代、消去和缩聚反应 |
| C.1mol对羟苯丙酮酸最多可与4molH2反应 |
| D.1mol尿黑酸最多可与含3molBr2的溶液反应 |
对于常温下pH为1的硝酸溶液,下列叙述正确的是
| A.该溶液lmL稀释至1000mL后,pH等于3 |
B.该溶液中水电离出的 是pH为3的硝酸中水电离出的 是pH为3的硝酸中水电离出的 的100倍 的100倍 |
C.该溶液中硝酸电离出的 与水电离出的 与水电离出的 之比值为 之比值为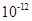 。 。 |
| D.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 |
标准状况下,将2.24LNH3通入1L 0.1mol/L的甲酸溶液中,欲确定所得溶液中NH4+、HCOO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
①NH3·H2O和HCOOH的电离常数②NH3·H2O和HCOONH4的电离常数③溶液的pH
| A.不需任何数据 | B.必需知道①、②、③三组数据 |
| C.只需知道①、③中的任一组数据 | D.只需知道①、②、③中的任一组数据 |
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)  2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
| A.30min时降低温度,40min时升高温度 |
| B.40min~54min之间反应速率v(正) < v(逆) |
| C.设20min和30min时的平衡常数分别为K1和K2,则K1 >K2 |
| D.0~8minA的平均反应速率为0.64mol/(L·min) |
下列各组物质,只用水就能加以区分的是
| A.溴蒸汽、二氧化氮两种气体 | B.己烯、甲苯、四氯化碳三种液体 |
| C.溴苯、苯、乙醛三种液体 | D.氯化钠、氯化铁、氯化钾三种固体 |
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是
| A.钠着火剧烈燃烧产生苍白色的火焰 |
| B.反应产生的大量白烟是氯化钠固体 |
| C.棉球①的作用是吸收过量氯气防止产生污染 |
| D.棉球②变蓝色则证明氯气未被碱液完全吸收 |
已知酸性 >H2CO3>
>H2CO3>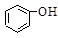 >HCO3―,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3―,向Na2CO3溶液中逐滴加入水杨酸(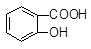 )溶液,可能发生的反应的离子方程式书写正确的是
)溶液,可能发生的反应的离子方程式书写正确的是
A.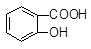 +CO32―→ +CO32―→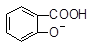 +HCO3― +HCO3― |
B.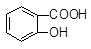 +CO32―→ +CO32―→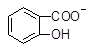 +HCO3― +HCO3― |
C.2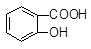 +CO32―→2 +CO32―→2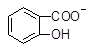 +CO2↑ +CO2↑ |
D.3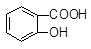 +2CO32―→3 +2CO32―→3 +HCO3―+H2O+CO2↑ +HCO3―+H2O+CO2↑ |
HF气体分子间容易缔合。某HF气体由HF、(HF)2、 (HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为
| A.51% | B.56% | C.49% | D.10% |
矿物白云母是一种重要的化工原料,其化学式的氧化物形式为
K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1)原子最外层有两个未成对电子的元素有_______;属于第三周期的非金属元素是______。
(2)上述元素中,形成的简单离子的半径由大到小的顺序为(Si除外)______________(填离子符号)。
(3)两种金属元素中,金属性较强的元素是_____,能说明这一事实的化学方程式是 (任写一个)。
(4)Al的最高价氧化物对应水化物在酸性溶液中的电离方程式为______________________。
以下反应①②可用于从不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反应①中的氧化剂是___________________;反应②中的还原产物是________________。
(2)根据反应①②可推知______。
a.氧化性:IO3->SO42- b.氧化性:MnO2>NaIO3
c.还原性:I->Mn2+ d.还原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③__________________________________________________________。
(4)三个反应中生成等量的I2时转移的电子数最少的是反应________(填序号)。
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
| A.3V正(H2)=2V逆(NH3) | B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 | D.容器中气体的分子总数不随时间而变化 |
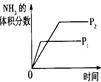
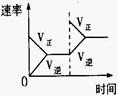
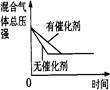
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为______________mol/(L¯min)。
(4)下列研究目的和示意图相符的是 。
| |
A |
B |
C |
D |
| 研究目的 |
压强对反应的影响(P1>P2) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
| 图示 |
 |
 |
 |
 |
实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。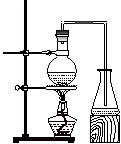

(甲) (乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点(℃) |
16.6 |
-89.5 |
-73.5 |
| 沸点(℃) |
117.9 |
117 |
126.3 |
| 密度(g/cm3) |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
可溶 (9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
① ;②
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。



A B C D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
c(一元酸) |
c(NaOH) /mol/L |
混合溶液的pH |
| 甲 |
c(HX)=0.1 mol/L |
0.1 |
pH = x |
| 乙 |
c(HY)=0.1mol/L |
0.1 |
pH = 7 |
| 丙 |
c(HZ)=0.1 mol/L |
0.1 |
pH = 9 |
(1)上述三种酸中一定属于强酸的是___________;
(2)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-) = mol/L;
(3)甲组中x的值_____7(填>、<、=);
(4)部分实验反应过程中的pH变化曲线如下图: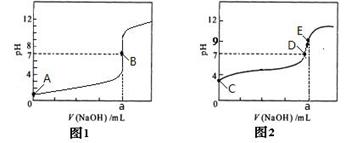
①表示乙组实验的pH变化曲线是________________
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
③E点对应离子浓度由大到小的顺序为 。
|
已知:①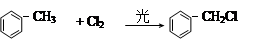
 R-CHCl-CH = CH2 + HCl
R-CHCl-CH = CH2 + HCl有机物M在工业上可作增塑剂,其合成有如下流程,其中A分子的苯环上的一卤代物只有2种。

(1)A的结构简式:_________________________
(2)D + H → M的反应条件:___________________
(3)A→D的反应类型是_______;F→G的反应类型是_______
A.加成反应 B.取代反应 C.消去反应 D.氧化反应
(4)I中的官能团的名称是___________________
(5)写出化学方程式:
B→C:__________________________________________________
C + D→E:___________________________________________________
已知:① ; ②
; ② ,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
(1)写出下列物质的结构简式:
A________________________、L________________。
(2)上述物质中互为同分异构体的是_______________(填符号);
(3)上述变化中,属于缩聚反应的是_______;属于消除反应的是_______(均填反应编号);
(4)物质B用盐酸酸化可得到产物W,W的同分异构体中,既属于酚类,同时也属于酯类的化合物有____种,请写出其中一种同分异构体的结构简式___________________;
(5)上述反应中的HCHO可以用甲烷和必要的无机原料制备,写出反应的化学方程式________________________________________________________________。
接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量 千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数 。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量 千克。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号