[安徽]2013届安徽省凤阳县中考模拟化学试卷
“十二五”期间我省大力实施“青山绿水”工程.下列不利于“青山绿水”工程实施的是( )
| A.把白炽灯换成LED节能灯 |
| B.积极推广太阳能等新能源使用,减少化石燃料使用 |
| C.加强生活污水处理,遏制水体富营养化 |
| D.将所有废弃塑料焚烧处理 |
高锰酸钾(KMnO4)、锰酸钾(K2MnO4)中钾的化合价为+1价,则锰元素的化合价分别是( )
| A.+3+2 | B.+2+3 | C.+7+6 | D.+6+7 |
果糖大量存在于水果中,其化学式为C6H12O6,下列关于果糖说法错误的是( )
| A.由碳、氢、氧三种元素组成 |
| B.由果糖分子构成 |
| C.一个果糖分子由6个碳原子,12个氢原子、6个氧原子构成 |
| D.碳、氢、氧三种元素的质量比为1:2:1 |
日常生活中,下列做法正确的是( )
| A.电视机着火时用水浇灭 |
| B.用钢丝刷擦洗铝锅上的污垢 |
| C.进入久未开启的菜窖前先进行灯火实验 |
| D.焚烧废弃塑料解决“白色垃圾” |
根据图的信息判断,下列说法正确的是( )
| A.硫属于金属元素 |
| B.硫原子的相对原子质量为32.07g |
| C.硫原子的核电荷数为16 |
| D.在化学反应中,硫原子容易失去电子 |
小明设计实验探究铁、铜、银三种金属的活动性顺序.他设计了四个实验方案,分别选择的试剂是:
①铜、银、硫酸亚铁溶液;
②铁、银、硫酸铜溶液;
③银、硫酸亚铁溶液、硫酸铜溶液;
④铜、硫酸亚铁溶液、硝酸银溶液.
上述四个方案所选试剂正确的是( )
| A.②④ | B.①②③ | C.①②③④ | D.②③ |
除去下列各物质中的少量杂质,所用方法不可行的是( )
| 选项 |
物质 |
杂质 |
除去杂质的方法 |
| A |
CuSO4溶液 |
稀H2SO4 |
加入足量氧化铜粉末充分反应后过滤 |
| B |
NaCl |
MgCl2 |
加入饱和NaCl溶液 |
| C |
Cu粉 |
Fe粉 |
用磁铁吸出 |
| D |
Na2CO3粉末 |
NaHCO3粉末 |
加热 |
甲、乙两种物质的溶解度曲线如图所示,下列叙述错误的是( )
| A.t1℃时,甲的溶解度小于乙的溶解度 |
| B.t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和 |
| C.t2℃时,甲或乙两种物质饱和溶液中溶质与溶剂的比是W:100 |
| D.将甲、乙饱和溶液的温度从t3℃降到t2℃时,乙先析出晶体 |
汽车是现代生活中不可缺少的代步工具.请回答下列问题
(1)汽车电路中的导线大都是铜制的这是利用了金属铜的延展性和 性.
(2)下列汽车配件及用品中,属于有机合成材料的是填序号下同 .
a钢铁外壳 b玻璃车窗 c橡胶轮胎 d羊毛座垫
(3)铁在潮湿的空气中容易锈蚀.
①汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝 和水.
②喷漆前需将铁制品放入稀盐酸中除锈,铁锈主要成分是Fe2O3,用化学方程式表示为什么可以用稀盐酸除铁锈 .
(4)回收利用生锈的铁制品是保护金属资源的有效途径.废铁粉中 Fe2O3含量大约在80%(其余20%为铁)左右,回收后在工业上常用一氧化碳将其还原,反应的化学方程式是 .
请根据下图回答问题:
(1)仪器A的名称是 ,仪器B的名称是 .
(2)用KClO3与MnO2混合制取和收集纯净O2,应选用上图中的 (填序号),反应的化学方程式 .
(3)实验室制取和收集CO2,应选用上图中的 (填序号),反应的化学方程式 ;如何检验已集满一瓶CO2气体: .
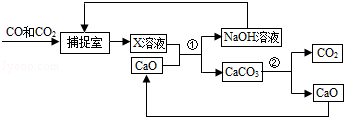
工业上常用“碳捕捉”技术将CO和CO2混合气体中的CO2捕捉并回收CO,其基本过程如图所示(部分条件及物质未标出).
(1)反应②分离出的CO2可制成干冰,干冰常用于 ;
(2)反应①在“反应分离室”内进行.将NaOH溶液与CaCO3分离的操作是 ;
(3)“捕捉室”中发生反应的化学方程式为 ;
(4)下列有关该捕捉过程的叙述正确的有 .
| A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放. |
| B.“反应分离室”中的反应要吸收大量热. |
| C.整个过程中,只有一种物质可循环利用. |
| D.能耗大是该捕捉技术的一大缺点. |
实验课上,小舟同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”并用实验加以验证
(1)他做了如下实验
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 |
无色酚酞试液变红 |
无色溶液中含有氢氧化钠 |
小玉认为小舟的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是:
(2)小玉设计了另一个实验:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量样品于试管中,加入 ②过滤,向滤液中滴加几滴硫酸铜溶液 |
③ ④ |
无色溶液中确实含有氢氧化钠 |
(3)小玉的实验可靠性高的原因是① .② .
某化学兴趣小组探究常温下碳酸钠饱和溶液的酸碱度.
【猜想与假设】溶液的pH可能是(填入你的猜想与假设):
①pH>7;②pH ;③pH .
[设计与实验]小方、小钟、小陈三位同学进行了如下实验:
小方:取pH试纸于玻璃片上,用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7.
小钟:取pH试纸于玻璃片上,先用蒸馏水润湿pH试纸,然后用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7.
小陈:取pH试直接浸入碳酸钠溶液中,测得pH>7.
【评价】以上三位同学中操作规范的是 同学,其余两位同学操作上的错误是 ; .
【结论】从物质的类别看,碳酸钠是一种 (填“酸”或“碱”或“盐”),它的溶液显碱性,说明显碱性的溶液 (填“一定”或“不一定”)是碱的溶液.
【应用】根据碳酸钠溶液显碱性,说出它在日常生活中的一种用途: .





 粤公网安备 44130202000953号
粤公网安备 44130202000953号