[福建]2012-2013学年福建省漳州市康桥学校高一下学期期中考试化学试卷
在“十二五”期间,江苏省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是( )
| A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 |
| B.加强城市生活污水脱氮除磷处理,遏制水体富营养化 |
| C.加大稀土资源的开采和出口,保证经济快速发展 |
| D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
下列表示物质结构的化学用语或模型正确的是( )
A.氯原子的结构示意图: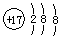 |
B.甲烷分子的球棍模型: |
C.氯化镁的电子式: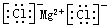 |
D.原子核内有8个中子的氧原子: |
X元素的最高价氧化物对应的水化物化学式为H2XO3,则它对应的气态氢化物的化学式为( )
| A.HX | B.H2X | C.XH3 | D.XH4 |
下列事实与氢键有关的是( )
| A.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高 |
| B.HF、HCI、HBr、HI的热稳定性依次减弱 |
| C.0℃时,水的密度比冰大 |
| D.水加热到很高的温度都难以分解 |
下列变化过程中,共价键被破坏的是( )
| A.烧碱固体溶于水 | B.氯化氢气体溶于水 | C.CO2气体变成干冰 | D.碘溶于酒精 |
下列有关化学概念的判断,正确的是( )
| A.SO2和SO3互为同分异构体 |
| B.二氧化碳和干冰互为同素异形体 |
| C.CH3CH2OH和 CH3-O-CH3互为同分异构体 |
| D.红磷和白磷互为同位素 |
在元素周期表的过渡金属中能找到( )
| A.制半导体材料的元素 | B.制农药的元素 |
| C.制催化剂的元素 | D.非金属元素 |
 为阿伏伽德罗常数,下列说法正确的是( )
为阿伏伽德罗常数,下列说法正确的是( )
A.1mol 所含质子数为 所含质子数为  个 个 |
B.10g氖气所含原子数为 个 个 |
C.标准状况下,22.4L 所含的分子数为 所含的分子数为 个 个 |
D.常温常压下,32g 气体所含原子数为 气体所含原子数为 个 个 |
锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性。下列关于锂的判断可能正确的是( )
A. 能在空气中燃烧 能在空气中燃烧 |
B. 熔点较低 熔点较低 |
C. 能溶于水 能溶于水 |
D. 受热易分解 受热易分解 |
现有七种气体:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ,其中不能用排水法收集的气体是( )
,其中不能用排水法收集的气体是( )
| A.①②③④⑤ | B.①③⑤⑥ | C.②③④⑤⑥ | D.③④⑤⑥ |
在一定条件下完全分解下列化合物40g,产生氧气36g,此化合物是( )
A. |
B. |
C. |
D. |
在无色透明强酸性溶液中,能大量共存的离子组是( )
A. 、 、 、 、 、 、 |
B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 |
D. 、 、 、 、 、 、 |
对于下列事实的解释错误的是( )
①蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
②浓硝酸的颜色变黄,说明浓硝酸见光易分解
③SO2气体通入溴水使溴水褪色,说明SO2具有漂白性
④常温下浓硫酸可用铁槽车储运,说明常温下浓硫酸跟铁不反应.
| A.①②③④ | B.③④ | C.只有③ | D.只有④ |
某溶液中可能含有 、
、 、
、 。为检验其中是否含有
。为检验其中是否含有 ,除加入
,除加入 溶液外,还需要的溶液是( )
溶液外,还需要的溶液是( )
A. |
B. |
C. |
D. |
下列离子方程式中正确的是( )
A.向 溶液中滴加稀盐酸: 溶液中滴加稀盐酸: + + + + + + = = + + |
B.往 溶液中加入 溶液中加入 粉: 粉: + + = = |
C.实验室制备氨气: |
D.往稀硝酸溶液中加入Cu粉: |
为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量 溶液,没有明显变化。由此可知该氮肥的主要成分是( )
溶液,没有明显变化。由此可知该氮肥的主要成分是( )
A. |
B. |
C. |
D. |
已知短周期元素的离子: 、
、 、
、 、
、 (m﹥n)都具有相同的电子层结构,则下列叙述中正确的是( )
(m﹥n)都具有相同的电子层结构,则下列叙述中正确的是( )
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C>D>B>A | D.单质的还原性:A>B>D>C |
把一小块金属钠投入到浓氨水中,逸出的气体为( )
A.全为 |
B.全为 |
C. |
D. 和 和 |
固体A的化学式为 ,它的所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
,它的所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.一个 分子中含4个N-H键 分子中含4个N-H键 |
B. 中只含有共价键 中只含有共价键 |
C. 的电子式是: 的电子式是:  |
D.它与HCl反应的离子方程式为 |
已知A、B、C、D是短周期中原子序数依次增大的4种主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的阳离子带3个单位的正电荷。下面推断结论正确的是( )
A.元素B的最高价氧化物是离子化合物
B.一定条件下,元素C、D的最高价氧化物对应的水化物都是强碱
C.工业上常用电解法制备元素D的单质
D.D的氧化物不溶于C的最高价氧化物对应的水化物
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④的最简单氢化物的电子式为 ,结构式 。
(2)③、⑦、⑧的最高价含氧对应的水化物的酸性最强的是 (填化学式)。
(3)④、⑥、⑦的原子半径由小到大的顺序为 。
(4)由①、②、③、④四种元素可形成多种既含有离子键又含有共价键的化合物,写出其中一种化合物的化学式 。
(5)元素③和元素⑧的氢化物极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,互相靠近时,可看到大量的白烟,写出产生该现象的化学方程式是 。
(6)用电子式表示②的最高价氧化物的形成过程: 。(7)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体X,其结构中原子的排列为正四面体,请写出X及其同素异形体的名称 、 。
A、B、C、C、E是含有一种相同元素的五种物质,可发生如下转化关系:其中A是一种淡黄色粉末固体单质;B是气态氢化物;C、D是氧化物;E是该元素最高价氧化物对应的水化物。
(1)元素A在元素周期表中的位置为 。
(2)B的名称是 。
(3)写出C的一种用途 ;
C的水溶液在空气中放置一段时间后溶液的pH减少,试说明其原因
。
(4)D溶于水发生反应的离子方程式 。
(5)E的浓溶液与碳单质反应的化学方程式 。
(1)下列五种物质中①Ar、② 、③
、③ 、④NaOH、⑤
、④NaOH、⑤ ,只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。
,只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在共价键的是 ,不存在化学键的是 。
(2)在以下过程中:①碘的升华、②烧碱熔化、③氯化铵受热分解、④石英熔化、⑤氯化钠溶于水、⑥氯化氢溶于水、⑦氧化钠溶于水、⑧碘溶于四氯化碳,未发生化学键破坏的是
(填序号,下同),仅发生离子键破坏的是 ,仅发生共价键破坏的是 ,既发生离子键破坏、又发生共价键破坏的是 。
某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答:
(1)仪器a的名称是 ,
应盛放下列药品中的 (填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的 (填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠 D. 碳酸钠
(3)b中反应的离子方程式为 。
若看到仪器C中的现象是 ,即可证明 比 酸性强(填化学式),得电子的能力 比 强。
用下图所示装实验置进行铜与浓硫酸反应的实验探究,请回答下列问题:
(1)试管A中发生反应的化学方程式为 。
(2)试管B中的实验现象是 ,将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是 。
(3)反应一段时间后,试管C中没有观察到沉淀生成,若往试管C中通入或加入一种物质X,即生成白色沉淀,该物质X不可能是下列的 。(填序号)
a、 b、
b、 c、
c、 d、
d、
(4)试管A中的铜和硫酸充分反应后,铜和硫酸都有剩余,下列物质中能使试管A中的铜片继续溶解的是 。(填序号)
a、 b、
b、 c、
c、 d、
d、
(5)试管D中的试剂是 溶液,其作用是 。
1.28g铜和一定量的浓硝酸反应,
(1)若反应生成的气体全部为 ,求消耗的
,求消耗的 的物质的量。
的物质的量。
(2)若随着铜的不断减少,反应生成的气体的颜色也逐渐变浅。当铜全部反应时,共收集到标准状况下气体1.12L,求反应中消耗的 的物质的量。
的物质的量。
 气体(标况下),求:
气体(标况下),求: 的物质的量浓度。
的物质的量浓度。 粤公网安备 44130202000953号
粤公网安备 44130202000953号