[云南]2012-2013学年云南大理州宾川第四高中高一12月月考化学试卷
给氧化还原反应下一个最本质的定义是:氧化还原反应都
| A.有电子的转移 | B.有单质的生成 | C.有单质参加反应 | D.有得氧和失氧 |
下列制取单质的反应中,化合物作还原剂的是
| A.Zn+H2SO4====ZnSO4+H2↑ | B.C+2CuO====2Cu+CO2 |
| C.Br2+2NaI====2NaBr+I2 | D.Cu+2AgNO3====2Ag+Cu(NO3)2 |
下列离子反应方程式正确的是
| A.Na2O2与水反应:2O22- + 2H2O = 4OH- + O2↑ |
| B.NaHCO3与盐酸:CO32- + 2H+ = H2O + CO2↑ |
| C.Ca(HCO3)2与过量的NaOH溶液反应:Ca2+ + 2HCO3- + 2OH- = CaCO3↓+ CO32- +2H2O |
D.醋酸与小苏打溶液反应H++HCO3-= CO ↑+H2O ↑+H2O |
在溶液中能够大量共存的一组离子是
| A.Na+、H+、CO32-、Cl- | B.Mg2+、Na+、Cl-、OH- |
| C.Na+、OH-、HCO3-、K+ | D.Ba2+、Cl-、Na+、OH- |
下列物质中,长期放置在空气中会发生氧化还原反应而变质的是
| A.Na2O2 | B.NaOH | C.Na2CO3·10 H2O | D.NaCl |
下列叙述中不正确的是
| A.钠在空气中燃烧后发出黄色的火焰。 |
| B.Na2O2是淡黃色固体,是强氧化剂,可用来漂白织物等。 |
| C.氧化剂在化学反应中得到电子,所含元素化合价都降低。 |
| D.离子方程式的书写时弱电解质、单质等写成化学式。 |
下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是
| A.Al + O2 | B.Na + O2 | C.NaOH + CO2 | D.C + O2 |
下列关于NaHCO3和Na2CO3的说法中,正确的是
| A.NaHCO3的热稳定性比Na2CO3的热稳定强。 |
| B.可以用加热的方法除去Na2CO3溶液中混有的少量NaHCO3。 |
| C.NaHCO3比Na2CO3容易溶于水。 |
| D.NaHCO3既能与盐酸发生反应,又能与NaOH溶液发生反应。 |
氢硫酸在空气中有如此反应:2H2S+O2==2S↓+2 H2O,下列不正确的是
| A.属于置换反应 | B.还原性:H2O> H2S |
| C.氧化性:O2> S | D.酸性:H2S> H2O |
CO与H2的分子个数比为1∶4的混合气体共2.1g,与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
| A.2.1g | B.3.6g | C.7.2g | D.不可求 |
下列物质属于电解质的是
①NaOH ②C2H5OH ③NH3 ④BaSO4 ⑤HCl ⑥Cu
| A.①④⑤ | B.①③⑤ | C.①④⑤⑥ | D.③④⑤ |
G、W、X、Y、Z均为含氯的化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G→W+NaCl ②W+H2O X+H2 ③Y+NaOH→G+W+H2O
X+H2 ③Y+NaOH→G+W+H2O
④Z+NaOH→W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是
| A.W、G、Z、Y、X | B.G、Y、W、Z、X |
| C.G、Y、Z、W、X | D.Z、X、G、Y、W |
溶液、胶体和浊液这三种分散系的本质区别是( )
| A.是否有丁达尔现象 | B.是否能通过滤纸 |
| C.分散质粒子的大小 | D.是否均一、透明、稳定 |
下图是分离混合物时常用的仪器,从左至右可进行的混合物分离操作分别是
| A.蒸馏、蒸发、萃取、过滤 | B.过滤、蒸发、萃取、蒸馏 |
| C.萃取、过滤、蒸馏、蒸发 | D.蒸馏、过滤、萃取、蒸发 |
①四氯化碳②汽油③酒精这三种溶剂能萃取碘水中的碘的是
| A.只有① | B.①和② | C.①和③ | D.①②③ |
下列说法正确的是
| A.22.4LN2含阿伏加德罗常数个氮分子 |
| B.在标准状况下,22.4L水的质量约为18g |
| C.22g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| D.在同温同压下,相同体积的任何气体单质所含的原子数相同 |
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
| A.①②③④ | B.①②③ | C.②③④ | D.①②④ |
为了除去铁粉中的少量铝粉,可以选用的试剂是
| A.稀盐酸 | B.稀硫酸 | C.氯化铜溶液 | D.氢氧化钠溶液 |
向明矾溶液中滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是
| A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中 |
| B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中 |
| C.全部为Al(OH)3沉淀 |
| D.几乎全部以AlO2-形式存在于溶液中 |
有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是
| A.Fe、Zn | B.Fe、Cu | C.Cu、Mg | D.Al、Fe |
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
下列物质中,在标准状况下,体积最大的是( )
| A.28g N2 | B.71g Cl2 | C.48g O2 | D.1 000g H2O |
同温同压下,相同体积的O2和O3具有相同的( )
| A.密度 | B.原子数 | C.质量 | D.分子数 |
配制一定物质的量浓度的某溶液,下列情况会使配制结果偏低的是( )
| A.未冷却即转移、定容 | B.未洗烧杯及玻璃棒 |
| C.定容时俯视刻度线观察液面 | D.容量瓶中原有少量蒸馏水 |
(12分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们,做了以下实验。
(1)将固体溶于水,搅拌后得到无色透明溶液;
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解,试判断:
固体混合物中肯定有 ;肯定没有 ;可能有 ;对可能有的物质,可采用往滤液中滴加 _____ 试剂的方法来检验。
操作(2)中反应的离子方程式 。
操作(3)中反应的化学方程式 。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B ;沉淀C ;沉淀D 。
(3)写出①、②、④三个反应方程式(属于离子反应的写离子方程式)
① ;
② ;
④ 。
实验室中制取少量干燥纯净的气体A,可用如图装置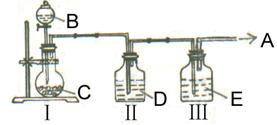
说明:Ⅰ中的漏斗为分液漏斗,转动活塞可以控制液体滴加的速率
⑴若A可以灭火,则A物质是 ,D物质是 ,Ⅱ的作用是 ,E物质是 ,Ⅰ中反应的离子方程式为 。
⑵若C物质是淡黄色粉末,则不需要Ⅲ装置,A物质是 ,B物质是 。Ⅰ中反应的离子方程式为 。
(6分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.蒸发结晶法 | D.分液法 E.渗析法 F.蒸馏法 G.过滤法 |
(1) ___________从氯化钠溶液中获得氯化钠固体;
(2) ___________分离溴水中的溴和水;
(3) ___________分离水和酒精;
 粤公网安备 44130202000953号
粤公网安备 44130202000953号