[福建]2012-2013学年福建省四地六校高一第一次月考化学试卷
下列化学用语书写正确的是( )
| A.碳酸氢钙CaHCO3 | B.钡离子Ba+2 |
| C.氦气 He2 | D.硫酸铝Al2(SO4)3 |
下列物质的分类正确的是( )
| |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
NaOH |
H2SO4 |
BaCO3 |
SO2 |
CO2 |
| B |
纯碱 |
H2S |
石灰石 |
SiO2 |
CO |
| C |
NaOH |
NaHSO4 |
CaCl2 |
Na2O |
SO2 |
| D |
KOH |
HNO3 |
CaCO3 |
CaO |
SO3 |
碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
| A.能使紫色石蕊试液变蓝色 | B.能与盐酸反应生成水 |
| C.能与Na2S04溶液反应生成BaS04沉淀 | D.能与CO2反应生成水 |
下列反应中不是氧化还原反应的是( )
| A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Cl2+SO2+2H2O = H2SO4+2HCl |
| D.2Na+2H2O =" 2NaOH" + H2↑ |
下列叙述中正确的是( )
| A.摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。 |
| B.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L。 |
| C.氧气的相对分子质量为32,氧气的摩尔质量也为 32g。 |
| D.1mol·L-1硫酸中含有NA个SO42- |
决定气体体积的主要微观因素是 ( )
| A.气体分子的数目和分子本身的大小 | B.气体分子的质量和分子本身的大小 |
| C.气体分子本身的大小和分子间的平均距离 | D.气体分子的数目和分子间的平均距离 |
某盐的混合物中仅含三种离子,其中0.45mol Mg2+,0.3mol Cl-,则SO42-的物质的量为( )
| A.0.1mol | B.0.3mol | C.0. 5mol | D.0.7mol |
若4g CO2中含有N个分子,则阿伏加德罗常数是( )
| A.11N/3 mol-1 | B.1/11N mol-1 | C.11Nmol-1 | D.3N/11 mol-1 |
NA为阿伏加德罗常数,下列叙述正确的是( )
| A.16 g氧气和16 g臭氧所含的原子数均为NA |
| B.常温常压下,11.2L氯气所含的原子数目为NA |
| C.2.3g钠由原子变成离子,失去的电子数为1.1NA |
| D.28g N2中所含的质子数目为7NA |
如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡一段时间后可见小球a 膨胀鼓起.下表中的各组物质不会出现上述现象的是( ) 
 |
X |
Y |
| A |
H2 |
Ca(OH)2 |
| B |
CO2 |
NaOH |
| C |
HCl |
Ba(OH)2 |
| D |
SO2 |
NaOH |
下列物质间的每一转化不能都通过一步反应实现的是( )
| A.Ca→CaO→CaCl2 | B.NaOH→Na2CO3→NaCl |
| C.O2→ CuO→Cu(OH)2 | D.C→CO2→Na2CO3 |
下列溶液中,氯离子浓度与50mL 1mol·L-1 AlCl3溶液中氯离子浓度相等的是( )
| A.150mL 1mol·L-1的NaCl溶液 | B.75mL 2mol·L-1的NH4Cl溶液 |
| C. 75mL 1mol·L-1的CuCl2溶液 | D.150mL 3mol·L-1的KCl溶液 |
等质量的CH4和NH3相比较,下列结论中错误的是( )
| A.两种气体的分子个数之比为17:16 |
| B.两种气体的原子个数之比为17:16 |
| C.两种气体的氢原子个数之比为17:12 |
| D.同温同压下,两种气体的体积之比为17:16 |
Fe、CuO 、MgSO4溶液、Ba(OH)2溶液、稀盐酸五种物质,在常温下两种物质间能发生的化学反应有( )
| A.3个 | B.4个 | C.5个 | D.6个 |
已知CO、CO2的混合气体质量共10 g,标准状况下体积为6.72 L,则混合气体中CO、CO2的质量及标准状况下的体积正确的为( )
| A.m(CO) = 4.2g | B.V(CO) = 2.24L |
| C.m(CO2) = 4.4g | D.V(CO2) =" 4.48L" |
下表有三组物质,每组均有甲、乙、丙三种物质(酸碱盐均为溶液)
| |
第一组 |
第二组 |
第三组 |
| 甲 |
BaCl2 |
NaOH |
Cu(NO3)2[来源 |
| 乙 |
Fe2O3 |
K2SO4 |
H2SO4 |
| 丙 |
Mg |
Fe |
MgCl2 |
(1)第二组中____(填化学式)与第一组所有物质都不反应,但与第三组所有物质都能反应;
(2)第三组中有一种物质能与第一组中的所有物质反应,这种物质是__________(填化学式)。
请写出相关化学方程式,并判断是否为氧化还原反应。(填“是”或“否”)
| |
相关化学方程式 |
氧化还原反应 |
| ①与甲 |
|
|
| ②与乙 |
|
|
| ③与丙 |
|
|
(每空各2 分,共16分)
(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比为___________ ,所含氧原子个数之比为___________
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为___________ g/mol,则含R 8.0g 的
NaR的物质的量为___________ mol
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为_________L,它与标准状况下________L硫化氢(H2S)含有相同数目的氢原子。
(4)中和浓度为4mol/L,体积为25mLH2SO4溶液,需要NaOH的质量为___________ g。
(5)已知8gA能与32gB恰好完全反应,生成22gC和一定量D,现将16gA与70gB的混合物充分反应后,生成2molD和一定量C,则D的摩尔质量为 ___ g/mol.
请根据所提供的试剂和仪器,按要求填空: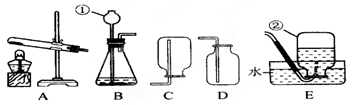
(1)写出带有标号①的仪器的名称___________
(2)气体发生装置A可用来制取氧气,其反应方程式为___________________________。选择的收集装置是______(选“C”或“D”)。若用E装置收集氧气完毕时,应先 (填序号①或②:①熄灭酒精灯;②从水中取出导气管)
(3)实验室用大理石固体与稀盐酸制备二氧化碳气体,写出反应的化学方程式:_________________________;选用上述装置中的_____________(填序号)作为发生装置;
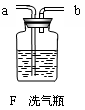
已知盐酸具有挥发性,二氧化碳气体中含有少量的氯化氢气体,可以用上图中的F装置除去HCl气体(F洗气瓶可吸收HCl气体,不吸收CO2气体,顺利使CO2气体进入下一个装置)。
实验中含有杂质的气体应该从_____________(填“a”或“b”)口进入洗气瓶,洗气瓶中应装_____________(填序号:
| A.NaHCO3溶液, | B.NaOH溶液, | C.澄清石灰水, | D.浓硫酸)写出洗气过程中反应的化学方程式____________________________________。 |
若把最后较为纯净的二氧化碳气体通入足量的氢氧化钠溶液中,气体被完全吸收,写出该反应的化学方程式____________________________________ 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号