[江苏]2012届江苏省吴江市九年级5月教学调研测试化学试卷
现代生活中出现了“铁强化酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的铁、钙、硒、氟应理解为
| A.元素 | B.分子 | C.单质 | D.原子 |
下列变化中,属于物理变化的是
| A.石油蒸馏 | B.雕像受到酸雨腐蚀 |
| C.葡萄糖在人体内氧化 | D.用富含淀粉的甘薯酿酒 |
下列对化学变化的主要特征认识正确的是
| A.有其他物质生成 | B.有能量变化 |
| C.物质的颜色和状态发生变化 | D.发光发热 |
下列有关物质用途的说法错误的是
| A.干冰可用作人工降雨 | B.聚氯乙烯薄膜可用于包装食品 |
| C.硝酸钾可用作复合肥料 | D.食醋可用于清除暖水瓶中的水垢 |
2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标,PM2.5是用来监测空气中下列哪项含量的
| A.二氧化碳 | B.一氧化碳 | C.二氧化硫 | D.可吸入颗粒物 |
自然界中存在氧循环和碳循环,其中能将二氧化碳转化为氧气的是
| A.光合作用 | B.水的吸收 |
| C.动植物的呼吸 | D.石油的燃烧 |
下列关于空气的说法中,错误的是
| A.空气是一种十分重要的天然资源 |
| B.少量有害物质进入空气中,依靠大自然的自净能力,空气仍能保持洁净 |
| C.工业上利用氧气和氮气的沸点不同,从液态空气中分离出氧气的过程属于物理变化 |
| D.按质量分数计,空气中约含有氮气78%、氧气21%、其他气体和杂质约占1% |
在一定条件下,下列转化不能由一步反应实现的是
| A.H2O2—→O2 |
| B.P—→P2O5 |
| C.CO2—→CO |
| D.SO2—→H2SO4 |
某溶液中存在大量的H+、Cl-、SO42-,该溶液中还可能大量存在的是
| A.CO32- | B.Ba2+ | C.Na+ | D.Ag+ |
下列说法不正确的是
| A.煮沸的汤比煮沸的水温度要高 |
| B.降低温度有可能使一杯硝酸钾的不饱和溶液变成饱和溶液 |
| C.不同温度下,同种溶质的饱和溶液,一定是温度高的饱和溶液的溶质质量分数大 |
| D.将100g质量分数为10%的氯化钠稀释到5%,需要加水100g |
下列措施有不利于改善环境质量的是
| A.将废电池深埋,以减少重金属的污染 |
| B.向煤中加入石灰石作为脱硫剂,可以减少SO2的排放 |
| C.利用太阳能、潮汐能、风力发电,以获取清洁能源 |
| D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料 |
下列说法不正确的是
| A.钢筋混凝土就是钢筋和混凝土的复合材料 |
| B.将地沟油回收再加工为食用油,以减缓水体富营养化 |
| C.淀粉、纤维素和蛋白质都是有机高分子化合物 |
| D.废塑料制品造成的“白色污染”已成为社会的一大公害 |
下列说法中错误的是
| A.CO燃烧是放热反应 |
| B.HCl与NaOH反应是放热反应 |
| C.CaO与H2O反应是吸热反应 |
| D.CaCO3受热分解是吸热反应 |
推理是化学学习中常见的思维方法。下列推理正确的是
| A.酸能使石蕊试液变红,CO2也能使紫色的石蕊试液变红,所以CO2是酸 |
| B.锌和铜均是金属,锌与稀硫酸反应生成氢气,则铜也能与稀硫酸反应生成氢气 |
| C.碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性 |
| D.溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小 |
下列说法中错误的是
| A.鱼类能在水中生活,证明氧气易溶于水 |
| B.食物的腐烂、金属的锈蚀都包含有缓慢氧化作用 |
| C.电解水生成氢气和氧气,说明水是由氢元素和氧元素组成的 |
| D.湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快 |
水是生命之源,下列有关水的说法错误的是
| A.水是一种重要的溶剂 |
| B.通过过滤可以除去水中所有的杂质 |
| C.生活中可以用煮沸的方法降低水的硬度 |
| D.用肥皂水可以区分硬水和软水 |
一种焰火火药中所含的硝酸铜在燃烧时放出绿色火焰,发生如下反应:
2Cu(NO3)2 2CuO+O2↑+4X↑其中X是一种污染空气的有毒气体,根据质量守恒定律,推测X是
2CuO+O2↑+4X↑其中X是一种污染空气的有毒气体,根据质量守恒定律,推测X是
| A.NO | B.NO2 | C.N2O | D.N2O5 |
卫生部等部门正式发布公告自201 1年5月1日起,禁止在面粉中添加过氧化钙作为食品添加剂。其中过氧化钙中氧元素的化合价与过氧化氢中氧元素的化合价相同,则过氧化钙的化学式正确的是
| A.Ca2O2 | B.CaO | C.CaO2 | D.Ca2O |
以下是同学们设计的几个实验方案,你认为合理的是
| A.用25mL蒸馏水和25mL酒精配制50mL酒精溶液 |
| B.将白醋滴在湿润的pH试纸上,测定其pH |
| C.向某固体中滴加稀盐酸,有气泡产生,该固体一定是碳酸盐 |
| D.用托盘天平、烧杯、玻璃棒、量筒、滴管、药匙等仪器来配制16%KNO3溶液 |
下列实验方案或结论正确的是
| A.用稀盐酸除去氧化铜粉中的镁粉 |
| B.根据加水溶解后溶液温度的变化,可以鉴别出硝酸铵和氢氧化钠两种固体 |
| C.向某无色溶液中滴加酚酞试液无现象,则溶液一定呈中性 |
| D.用熟石灰粉末与之混合、研磨,可鉴别硫酸铵和氯化铵两种化肥 |
下列反应中属于置换反应的是
A.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
B.2H2O 2H2f+O2 ↑ 2H2f+O2 ↑ |
| C.Fe+H2SO4==FeSO4+H2 ↑ |
| D.2KOH+H2SO4=K2SO4+2H2O |
工业上用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是
A.甲的化学式为CH2
B.反应中甲、乙、丙的分子个数比为2:1:1
C.甲、乙、丙都是有机物
D.丙中C、H、O元素的质量比为12:3:8
在盛有AgNO3和Mg(NO3)2混合溶液的试管中,加入一定量的锌粉充分反应,试管底部有少量固体存在。过滤,向滤液中加稀盐酸,产生白色沉淀。滤渣是
| A.Mg | B.Ag |
| C.Zn和Ag | D.Zn和Mg |
某校化学兴趣小组设计用下图所示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。[查阅资料]:①Fe与浓H2SO4反应,加热,有SO2生成;②C与浓H2SO4反应,加热,有CO2和SO2生成;③SO2可使澄清石灰水变浑浊;④SO2可使品红溶液的红色褪去,而CO2不能;⑤SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能;⑥碱石灰的主要成分为NaOH和CaO。
[实验探究]称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg。下列对实验结果分析正确的是
| A.B装置作用是为了除去反应中生成的SO2 |
| B.依据实验数据计算得出铁的质量分数为(3b-11m)/11m |
| C.装置内的CO2难以赶尽,E质量偏小,导致铁的质量分数偏小 |
| D.SO2未被酸性KMnO4除尽也可能会引起铁的质量分数偏小 |
化学就在我们的身边,它与我们的生活息息相关。请从
| A.生石灰 | B.小苏打 | C.明矾 | D.氨气E.油脂F.纯碱这六种物质中,请选择适当的物质名称前的字母序号填空。 |
(1)热值最高的营养物质是 ; (2)能使湿润的红色石蕊试纸变蓝 ;
(3)净化水时可作絮凝剂的是 ;(4)人们设想用它来中和法阻止海水酸化的是 ;
(5)可用于焙制糕点的物质是 ; (6)用于生产玻璃、造纸工业的是 。
学好化学能使我们更好地认识各种现象,更合理地解决实际问题,更轻松地应对生活中可能出现的突发事件。
(1)下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,发现甲、乙、戊中铁钉生锈快慢的顺序为 ,通过这五个实验可以得出的结论是: 。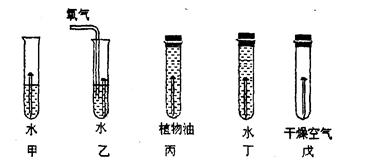
(2)不同的火灾所采取的灭火方式也有所不同。如扑灭火势凶猛、蔓延迅速的森林火灾时通常采取的方法是 ;扑灭用电线路老化而引起的火灾时应先 ,再进行灭火。
(3)下图是A、B、C三种物质的溶解度曲线,根据下图回答下列问题: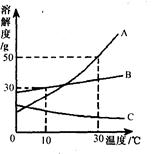
①30℃时向两个都盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,溶液的溶质质量分数较大的是 溶液(填“A”或“B”)。
②将10℃的A、B两种物质的饱和溶液降温至0℃,析出固体的质量大小是A B(填“>”,“<”,“=”或“无法判断”)。
③将30℃A、B、C饱和溶液降温至10 ℃,所得溶液溶质质量分数由小到大的顺序是 。
④A物质的饱和溶液中含有少量B物质,通过 方法可以提纯其中的A物质。
下图是化学反应的溶液颜色变化体现了“魔法世界,魅力化学”。请回答:
(1)溶液X是 (填“酸”“碱”或“盐”),试剂A的名称是 。
(2)X是稀硫酸、B是氧化物,则B的化学式为 。
(3)X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀硫酸、D是碱,则X与D反应的化学方程式为 。
某大理石中的主要杂质是氧化铁,工业上由该大理石制备CaCO3的主要流程如下,请根据图示回答下列问题:
(1)加入的试剂A是 ,加入的试剂B是 。
(2)操作①的名称是 ,操作②的名称是 。
(3)写出加入试剂C后发生反应的化学方程式: 。
以下是我们熟悉的实验室制取气体的发生装置、收集装置。请根据装置图回答下列问题:
(1)实验室制取二氧化碳应选用的装置为 (填装置的编号),写出该反应的化学方程式: 。
(2)写出用上述装置A制取氧气的化学反应方程式: 。若选择装置B制取氧气,如果锥形瓶内反应太剧烈,可减慢反应最方便的方法是 。
(3)常温下NO是一种无色、难溶于水的气体,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体。请你利用下图仪器I、Ⅱ,设计收集一瓶较纯净的NO的操作方法: 。
2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查
②CO还原Fe2O3的化学方程式为 ;
③在f处点燃气体的目的是 。
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用。
①d瓶中应装 (填序号)。
| A.澄清石灰水 | B.水 | C.石蕊溶液 | D.浓硫酸 |
②该实验这样改进的主要优点是 。
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数。小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
①由上表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是 的质量。
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程)。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号