[辽宁]2012届辽宁省鞍山市九年级第一次中考模拟考试化学试卷
下列事实与化学无关的是
| A.发展低碳经济,保护环境 | B.日食的产生 |
| C.开发新能源,研制新材料 | D.药物和保健品的研制 |
下列物质的用途中,主要是利用其化学性质的是
| A.用粮食酿造酒 | B.用石墨作铅笔芯 |
| C.用铜丝作导线 | D.用干冰作制冷剂 |
据报道,化学家创造出对CO2有较强吸收能力的糖粉状物质—“干水”,其每个颗粒含水95﹪,外层是SiO2。下列说法正确的是
| A.干水吸收CO2的过程中只发生物理变化 |
| B.干水是一种混合物 |
| C.干水中的分子不再运动 |
| D.干水和干冰是同一种物质 |
小强同学在做家庭小实验时,向久置的石灰水吹气,发现石灰水没有浑浊。面对“异常”现象,他不应该采取的做法是
| A.向老师请教 | B.查找相关资料,探究原因 |
| C.认为自己做错了,继续做其它实验 | D.反复实验,并观察是否有相同现象 |
如图所示的加热方式叫“热水浴”。针对“热水浴”,下列说法错误的是 
| A.三脚架上应该垫上石棉网 |
| B.试管内试剂受热比较均匀(和用酒精灯直接加热相比) |
| C.如果试管中盛有硬度较大的硬水,长时间加热不会有任何变化 |
| D.如果试管中为饱和的石灰水,加热后试管中出现浑浊 |
碘—131原子核内共有53个质子和78个中子,其核外电子数为
| A.53 | B.78 | C.131 | D.25 |
用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是
| A.量筒、烧杯、漏斗、玻璃棒 | B.托盘天平、玻璃棒、药匙、烧杯 |
| C.托盘天平、玻璃棒、量筒、烧杯 | D.玻璃棒、量筒、烧杯、胶头滴管 |
实验室许多药品需要密封保存。下列药品需密封保存的原因,解释错误的是
| A.浓盐酸——防止挥发 | B.NaOH溶液——防止与CO2反应 |
| C.浓硫酸——防止吸水 | D.生石灰——防止与氧气反应 |
下列物质间的转化,不能一步实现的是
| A.NaNO3 → NaCl | B.O2 → H2O | C.H2SO4 → HCl | D.CuCl2 →Cu |
“魔棒点灯”趣味实验的操作为:取少量高锰酸钾晶体放在表面皿上,在高锰酸钾上滴加2~3滴浓硫酸,用玻璃棒蘸取后去接触酒精灯的灯芯,酒精灯立刻被点燃了。你认为酒精灯能被点燃的主要原因是
| A.“魔棒”具有神奇的功力使酒精灯点燃 |
| B.高锰酸钾与浓硫酸的混合物能降低酒精灯的着火点,使酒精自发燃烧 |
| C.它们之间发生化学反应,产生大量氧气,酒精在氧气浓度大的环境中能自燃 |
| D.它们之间发生化学反应,放出大量的热,使温度达到酒精的着火点 |
下列图像能正确反映其对应操作中各量变化关系的是
| A.图①是给氯酸钾和二氧化锰的混合物加热 |
| B.图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 |
| C.图③是向pH=1的酸溶液中不断加水 |
| D.图④是向一定质量的稀硫酸中加入锌粒 |
在“生石灰、明矾、碳酸钙、不锈钢、聚乙烯、纯碱”中选择适当的物质填空。
(1)用于制造医疗器械、炊具的是 ;(2)用作食品干燥剂的是 ;
(3)用于造纸、纺织工业的盐是 ;(4)用作补钙的盐是 ;
(5)属于有机高分子化合物的是 ;(6)净化水时可作絮凝剂的是 。
右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。
(1)A点的含义 。
(2)t2℃时,100g水中溶解40g甲,溶液刚好饱和;那么,50g水中溶解 g甲,溶液达到饱和。
(3)t1℃时,若要将甲物质的不饱和溶液变为饱和溶液,可采用的方法是 (写出一种即可)。
(4)t2℃时,甲、乙的饱和溶液分别降温至t1℃,析出晶体较多的是 (写“甲”、“乙”或“无法确定”)
防腐剂山梨酸钾的化学式为C6H7KO2,试回答:
(1)山梨酸钾由 种元素组成。
(2)山梨酸钾的相对分子质量为 。
(3)山梨酸钾中钾元素的质量分数为 。
硫酸产量标志着一个国家化工业发展的水平。工业生产硫酸的主要流程为:
①煅烧黄铁矿4FeS2+11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
②SO2转化为SO3 ③用浓H2SO4吸收SO3 请回答相关问题:
(1)如何利用流程①中形成的固体剩余物: 。
(2)SO2具有与CO2相似的化学性质。有人设计用熟石灰吸收尾气中的SO2,请写出此反应的化学方程式 。
(3)第②步反应是一个化合反应,请判断实现此反应的另一反应物是 。
(4)将SO2和Cl2通入水中至恰好完全反应,生成两种常见的酸,请完成下列化学方程式:Cl2+SO2+2H2O=== +2HCl
(5)实验室稀释浓硫酸的方法是:
。
比较与分析归纳会使你变得更聪明。请分析下表中信息,回答有关问题:
| 名称 |
符号 |
原子结构示意图 |
单质的 化学式 |
常温常压下 状态 |
单质与氢气反应 |
| 氟 |
F |
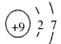 |
F2 |
气态 |
黑暗处爆炸 |
| 氯 |
Cl |
 |
Cl2 |
气态 |
光照爆炸 |
| 溴 |
Br |
 |
Br2 |
液态 |
加热反应 |
| 碘 |
I |
 [ [ |
I2 |
固态 |
持续加热缓慢反应 |
⑴上述表中X=
⑵①试归纳氟、氯、溴、碘的原子结构规律(答一点即可):
;
②试归纳氟、氯、溴、碘对应单质的性质变化规律(答一点即可):
;
⑶已知:Cl2和Br2的化学性质相似,Cl2+H2O=HCl+HClO,其中HClO也是一种酸,它与氢氧化钠溶液反应的反应方程式为:HClO+NaOH=NaClO+H2O,试分别写出Br2与水,Br2与NaOH溶液反应的化学方程式:
;
。
A、B、C、D、E五瓶无色透明溶液,分别是稀盐酸、Na2CO3溶液、MgCl2溶液、NaNO3溶液、NaOH溶液中的一种。分别进行下列实验:
Ⅰ.将A分别滴入B、C、D、E中,均没有明显现象。
Ⅱ.将B分别滴入C、D、E中,C、E中均产生白色沉淀,D中没有明显现象。
Ⅲ.将C分别滴入D、E中,D中有气泡冒出,E中没有明显现象。
(1)A是 ,B是 ,C是 ;
(2)B加入E中的化学方程式是 ;
(3)C加入D中的化学方程式是 。
仅利用括号里的试剂,一次可以直接鉴别出组内物质的组是 (填序号,下同);利用括号里的试剂以及组内各物质之间的相互反应,可以鉴别开来的是 。
| 组别序号 |
待测物质 |
试剂 |
| 1 |
溶液:氢氧化钡、稀硫酸、稀盐酸 |
(酚酞试液) |
| 2 |
气体:氢气、二氧化碳、一氧化碳 |
(澄清石灰水) |
| 3 |
固体:氢氧化钠、氯化钠、硝酸铵 |
(水) |
| 4 |
固体:氯化铁、碳酸钡、氯化银 |
(稀盐酸) |
(10分)实验室常用下图中A~E装置制取和收集气体。
(1)写出B图中标有①的仪器名称 。
(2)甲同学用氯酸钾和二氧化锰反应制取氧气,应选择的发生装置是 ,(写字母,下同)收集装置是 。
(3)乙同学认为B装置可用于双氧水和二氧化锰混合制取氧气,其反应的化学方程式为 ,其中二氧化锰起 作用。
(4)丙同学用右图所示装置作制取二氧化碳的发生装置。
该装置的优点是 。
可以选择哪一种金属材质的网袋替代塑料网袋(从银、铜、铁中选择)?简要说明选择的理由。
铝制品却不宜长时间盛放腌制食品。资料显示:“铝制品表面虽然有一层致密的氧化膜保护……氯化钠也会破坏氧化膜的结构,加速铝制品的腐蚀。”
【提出问题】氯化钠溶液中的哪一种离子对铝制品表面的氧化膜产生了破坏作用?
【实验方案】请填写下面表格中的空格。
| 序号 |
实验1 |
实验2 |
实验3 |
| 方 案 |
 |
 |
 |
| 现 象 |
A中铝片表面有红色固体析出; B中铝片无明显现象。 |
|
与A中的现象相同 |
| 结 论 |
溶液中对氧化膜产生了破坏作用的离子可能是 。 |
除去表面氧化膜的铝片会与CuSO4溶液反应。该反应 的化学方程式 。 |
验证了实验1的结论。 |
【反思】针对实验3,同学认为还应增做一个对比实验,方案是向 (从“A、B、C、D”中选择)试管中再加入Na2SO4溶液,结果无明显现象。该实验可证明溶液中对氧化膜不产生破坏作用的离子是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号