[安徽]2012届安徽省当涂县第三次四校联考中考模拟化学试卷
医生建议小明多吃水果和蔬菜。医生的建议主要让他补充的营养素是( )
| A.蛋白质 | B.糖类 | C.油脂 | D.维生素 |
据2012年中央电视台3.15晚会报道:液化石油气掺入二甲醚(C2H6O)成行业潜规则,二甲醚对液化气罐的配件有腐蚀性,严重会造成爆炸。下列关于二甲醚的说法错误的是( )
A.由C、H、O三种元素组成 B.相对分子质量46
C.是一种氧化物 D.碳、氢、氧三种元素质量比为12∶3∶8
钾是维持人体生命和植物生长所必须的元素。下图是从元素周期表中得出的部分信息。下列关于钾元素的有关叙述错误的是( )
| A.钾元素的原子序数为19 |
| B.钾元素在人体及植物体内以单质形式存在 |
| C.钾元素的相对原子质量为39.10 |
| D.施用草木灰,可给农作物补充钾元素 |
下列说法正确的是( )
| A.食用用“瘦肉精”喂养的猪肉对人体无害 |
| B.工业废水和生活污水处理达标后才能排放 |
| C.“地沟油”价格便宜,可放心食用 |
| D.明胶是生产药用胶囊的原料,明胶中铬含量超标对人无害 |
下列选用的除杂试剂或方法错误的是(括号内为杂质)( )
| 选项 |
物质 |
杂质 |
试剂或方法 |
| A |
NaCl固体 |
泥沙 |
加水溶解、过滤、蒸发 |
| B |
Cu粉 |
Fe粉 |
用磁铁吸出 |
| C |
N2 |
O2 |
通过红热的铜丝 |
| D |
CO2 |
CO |
在空气中点燃 |
根据下列化学反应微观示意图得出的结论中,正确的是( )
| A.甲的化学式为CH2 | B.反应中甲、乙、丙的分子个数比为2:1:1 |
| C.丙是纯净物 | D.甲、乙、丙都是有机物 |
固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如右图所示。下列说法错误的是( )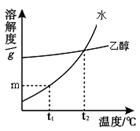
| A.物质W能溶解在水和乙醇中 |
| B.t1℃时,物质w在水中的溶解度为m克 |
| C.t2℃时,物质W在水中与在乙醇中的溶解度相同 |
| D.将t1℃时物质w的饱和水溶液升温至t2℃有晶体析出 |
下图所示是液态二氧化碳灭火器,请回答下列问题。
(1)图中所标物质中属于金属材料的是___________(只写一种)属于有机材料的是______(只写一种)。
(2)加压在小钢瓶中液态二氧化碳喷出后能灭火。其原理是____________和_________
(3)在钢瓶表而涂油漆的作用是_________________________。
(4)比较铁和铜的金属活动性强弱可采用_____________________________________的方法。
为减少化石燃料的使用,降低污染,各国都在积极进行技术创新。
(1)美国科学家发明了一种“发电叶子”,将这种叶子放入水中,在太阳光照射下,叶子中的催化剂会将水分解成氢气和氧气储存在氢氧燃料电池中,再转化为电能,供家庭用电需求。
①整个过程中都发生了哪些形式的能量转化?_______________________。
②“发电叶子”产生氢气、氧气的化学方程式为_________________________。
(2)我国积极改进风电技术,扩大风电使用,并配套大型储能设备——“全钒液流”储能电池,以保证稳定供电。
①与煤炭火力发电相比,风力发电的优点是___________________________。
②“全钒液流”储能电池中有VO2+,其中钒元素(V)的化合价是_______价。
(3)为了降低汽车排放的尾气对空气的污染,现在的大部分汽车都安装了催化式排气净化器。右图列举的是几种气体在净化器中转换前后的变化。
①根据右图所提供的信息,举例说明催化式排气净化器是如何降低汽车尾气污染的。____________________________________________________________________。
②为了使汽车尾气的污染更小,研究催化式排气净化器的专家们还要注意什么问题。________________________________________________________________。
下图是实验室制取气体的常用装置。
(1)仪器①的名称是_________________。
(2)用金属锌和稀硫酸反应制取氢气的化学方程式为__________________________;反应的发生装置是(填装置字母,下同)________;收集氢气应选择装置______。
(3)写出木炭在空气中充分燃烧的化学方程式_______________________________。
用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:
(1)写出下列物质的化学式:硝酸钙__________、碳酸铵___________。
(2)硝酸钙与碳酸铵在溶液中反应,其基本反应类型为___________。
(3)实验室常采用______________操作进行沉淀分离。
(4)生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是:
________________________________________________________。
(5)高纯氧化钙生产过程中,“干燥”的主要目的是为了防止(用化学方程式表示)
________________________________________________________。
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛。小红同学设计实验对碳酸氢钠的性质进行了探究。请你参与她的探究活动。
【生活应用】请说出碳酸氢钠在日常生活中的一种用途:___________________。
【探究实验1】碳酸氢钠溶液的酸碱性。
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。现象:溶液变成浅红色。结论:__________________________。
【探究实验2】能与酸反应。
【实验方案】取少量该固体加入试管中,滴加稀盐酸。现象:__________________________。
反应的化学方程式为:_______________________________________。
【探究实验3】碳酸氢钠的热稳定性。
【实验方案】设计实验装置如右图,并进行实验。
现象:试管口有水珠出现,澄清石灰水变浑浊。充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳、水和白色固体生成。
请你帮小红设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH。(所选试剂不能用酸)注意:若答以下两空奖励4分,但化学总分不超过60分。
步骤:________________________________________________;
现象:________________________________________________。
写出碳酸氢钠受热发生反应的化学方程式:________________________________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号