[湖北]2011-2012学年湖北省洪湖市四校高二下学期期中联合考试化学试卷
下列关于有机化合物的表示法中正确的是
| A.乙醛的结构简式为CH3COH | B.丙醇的结构式CH3CH2CH2OH |
| C.丙炔的结构简式CH3CCH | D.甲烷的的电子式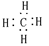  |
下列电子排布式属于基态原子的电子排布式的是
| A.1s22s12p1 | B.1s22s22p3 | C.1s22s22p63p1 | D.1s12s1 |
相同质量的下列各烃,完全燃烧后生成二氧化碳最少的是
| A.甲烷 | B.乙烷 | C.乙烯 | D.乙炔 |
下列说法不正确的是
| A.由2H2(g)+O2(g)=2H2O(l)△H= —571.6 kJ/mol 可知氢气的燃烧热△H= —285.8 kJ/mol |
| B.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
| C.电解精炼铜时以粗铜作阳极 |
| D.对于一个给定的可逆反应,平衡常数只与温度有关,与浓度、压强无关 |
在由水电离出的c(OH—)=1×10—13 mol•L—1的溶液中一定大量共存的离子组是
| A.Cu2+、Na+、NO3—、SO42— | B.Mg2+、K+、Br—、AlO2— |
| C.Na+、NH4+、S2O32—、Cl— | D.Ba2+、K+、NO3—、Cl— |
构成下列物质的粒子中所含化学键的类型和该固态物质晶体类型均相同的是
| A.HCl和NaCl | B.CO2和SiO2 | C.CH4和CCl4 | D.Na2O2和H2O2 |
下列说法中不正确的是
| A.质谱、红外光谱、核磁共振氢谱均为鉴定有机物结构的化学方法 |
| B.目前有许多测定相对分子质量的方法,质谱法是最精确、快捷的方法 |
| C.从红外光谱图中可以获得分子中含有何种化学键或官能团的信息 |
| D.从核磁共振氢谱图上可以推知有机物分子中有几种不同类型的氢原子及它们的数目 |
下列反应:(I)1—溴丙烷与2—溴丙烷分别和氢氧化钠醇溶液混合加热
(II)1—溴丙烷与2—溴丙烷分别和氢氧化钠水溶液混合加热,关于反应中生成的有机物的说法中正确的是
| A.(I)和(II)产物均不同 | B.(I)和(II)产物均相同 |
| C.(I)产物相同,(II)产物不同 | D.(I)产物不同,(II)产物相同 |
下列有关实验现象的描述正确的是
| A.乙炔燃烧时火焰明亮并伴有黑烟 |
| B.在苯和甲苯中分别滴加几滴高锰酸钾酸性溶液振荡,高锰酸钾酸性溶液均褪色 |
| C.在乙醇中加入黄豆粒大小的金属钠,钠浮在液面上,熔化成光亮的小球,反应剧烈而迅速消失 |
| D.在溴乙烷和氢氧化钠溶液共热后的溶液中,加几滴硝酸银溶液产生淡黄色沉淀 |
若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A.a =" b+" m + n B.离子半径Am+<Bn-
C.原子半径A>B D.A、B一定都是短周期元素
下列离子方程式书写正确的是
| A.硫酸亚铁溶液中加入过氧化氢溶液:Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O |
| B.氯化铝溶液中加入过量氨水:Al3++ 3 NH3·H2O = Al(OH)3↓ + 3 NH4+ |
| C.次氯酸钙溶液中通入过量的二氧化碳:Ca2+ +2ClO—+ H2O + CO2 = CaCO3↓+ 2HClO |
| D.在氨水中通入少量的二氧化硫反应:NH3·H2O + SO2 = NH4+ + HSO3— |
下列说法中正确的是
| A.P4和CH4都是正四面体分子且键角都为109o28ˊ |
| B.CO2、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| C.具有共价键的晶体叫做原子晶体,一定具有高的熔、沸点及硬度 |
| D.H—F的键能为568 kJ/mol,H—Cl的键能为431.8 kJ/mol,这可以说明HF分子比HCl分子稳定 |
已知某可逆反应:mA(g)+nB(g)  pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
| A.T1<T2,p1>p2,m+n<p,△H>0 |
| B.T1>T2,p1<p2,m+n<p,△H<0 |
| C.T1>T2,p1<p2,m+n>p,△H>0 |
| D.T1>T2,p1>p2,m+n>p,△H<0 |
(17分)A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族。A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为: ,E的价层电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______ B_______ C _______ D _______
(2)用元素符号表示A、C、D电负性由小到大的顺序____________。
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____。
(4) D的氢化物比A的氢化物的沸点_____(填"高"或"低"),A的氢化物分子立体构型为________。
(5) E元素在周期表的位置是______________。
(6) B、C、D最高价氧化物的晶体类型是分别是______、________、______。
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 |
A |
B |
C |
| 初始浓度/mol•L—1 |
0.020 |
0.020 |
0 |
| 平衡浓度/mol•L—1 |
0.016 |
0.016 |
0.0080 |
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是Ⅰ________;Ⅱ________;Ⅲ________;Ⅳ________(将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是_______________;
(3)使用装置Ⅱ的目的是_________________;
(4)使用装置Ⅲ的目的是_________________;
(5)确定含有乙烯的现象是_________________。
(12分)乙炔是最简单的炔烃,实验室可以用电石(主要成分CaC 2)与水反应制备乙炔。乙炔是一种重要的有机化工原料,在催化剂存在的条件下,加热至150℃~160℃,乙炔与氯化氢发生反应,生成重要的化工原料氯乙烯。以乙炔为原料在不同的反应条件下还可以转化成以下化合物。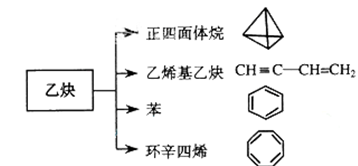
完成下列各题:
(1)写出实验室制备乙炔的化学方程式_____________________________________
(2)写出制备氯乙烯的化学方程式______________________________________。
(3)乙炔中C原子的杂化方式是____________________。
(4)正四面体烷的核磁共振氢谱图中有___________个峰。
(5)关于乙烯基乙炔分子的说法正确的是:________________
a 、乙烯基乙炔不能使溴的四氯化碳溶液褪色
b 、乙烯基乙炔分子内只含有一种官能团
c 、1mol乙烯基乙炔最多能与3molH2发生加成反应
d 、等物质的量的乙炔与乙烯基乙炔完全燃烧时的耗氧量为1:2
e 、等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同
f 、乙烯基乙炔与正四面体烷互为同分异构体
(6)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:_________

 粤公网安备 44130202000953号
粤公网安备 44130202000953号