[福建]2011-2012学年福建省五校高一上学期期末联考化学试卷
科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入研究。下列4组物质:①Mg、O2、N2、NO;②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2、CO2、SiO2.从物质的基本分类看,每组中都有一种物质与其他物质不属于同一类,这4种物质分别是( )
| A.Mg、Na2CO3、H2CO3、CaO | B.O2、NaOH、H2SO4、SiO2 |
| C.NO 、CH4、NH3·H2O、 CaO | D.NO、KCl、H2SiO3、 SO2 |
下列类型的反应,一定没有发生电子转移的是( )
| A.化合反应 | B.分解反应 | C.复分解反应 | D.置换反应 |
下列情况会对人体健康造成较大危害的是( )
A 自来水中通入少量Cl2进行消毒杀菌
B 用SO2漂白食品
C 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D 用小苏打(NaHCO3)发酵面团制作馒头
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
能够用来鉴别BaCl2 、NaCl 、Na2CO3三种物质的试剂是( )
| A.AgNO3溶液 | B.稀硫酸 | C.稀盐酸 | D.稀硝酸 |
用NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A.常温常压下,18g 18O2中含有NA个氧原子 |
| B.标准状况下,2.24 L水所含分子数为0.1NA个 |
| C.标准状况下,22.4 L空气含有NA个分子 |
| D.常温常压下,1.6克甲烷气体中含有的电子数为NA; |
2molCl2和2molCO2相比较,下列叙述中正确的是( )
| A.分子数相等 | B.原子数相等 | C.体积相等 | D.质量相等 |
下列说法正确的是( )
| A.二氧化硅易溶于水 |
| B.硅单质常用作半导体材料、太阳能电池和光导纤维 |
| C.金属钠常保存在煤油中 |
| D.NaOH溶液通常保存在带玻璃塞的磨口试剂瓶中; |
下列反应的离子方程式书写正确的是 ( )
| A.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| B.金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2 |
| C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ |
| D.铁跟稀硫酸反应:Fe+2H+=Fe3++H2 |
下列叙述正确的是( )
| A.SO2具有还原性,故可作漂白剂 |
| B.Na的金属活性比强,故可用Na与MgCl2溶液反应制Mg |
| C.浓硫酸具有吸水性,故可作干燥剂。 |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他金属反应的产物中的Fe也显+3价 |
下列物质属于非电解质的是( )
| A.NH3 | B.(NH4)2SO4 | C.Cl2 | D.CH3COOH |
下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是( )
| A.150 mL 1 mol·L-1的MgCl2 | B.75 mL 2 mol·L-1的NH4Cl |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |
下列关于钠的叙述错误的是 ( )
| A.钠在常温下就容易被氧化 | B.钠在空气中燃烧生成Na2O |
| C.钠燃烧时发出黄色的火焰 | D.钠的密度比水小,熔点低于100℃ |
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A.AgNO3 | B.FeCl2 | C.Na2SO3 | D.AlCl3 |
除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
| A.通入二氧化碳气体 | B.加入氢氧化钡溶液 |
| C.加入澄清石灰水 | D.加入稀盐酸 |
用等质量的金属钠进行下列实验,产生氢气最多的是( )
| A.将钠放入足量的稀盐酸中 |
| B.将钠放入足量的稀硫酸中 |
| C.将钠放入足量的氯化钠溶液中 |
| D.将钠用铝箔包好,并刺一些小孔,放入足量的水中 |
下列物质在空气中久置最不易变质的是 ( )
| A.过氧化钠 | B.硅酸钠溶液 | C.纯碱 | D.亚硫酸钠 |
下列转化必须加入还原剂才能实现的是
| A.H2SO4→ SO2 | B.Zn→ Zn2+ | C.H2→H2O | D.Cl2→Cl- |
下列关于氯的说法正确的是 ( )
| A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂 |
| B.1735Cl、1737Cl为不同的核素,有不同的化学性质 |
| C.实验室制备Cl2,不宜用排水法收集 |
| D.液氯属于混合物 |
现在MgCl2 AlCl3 CuCl2 FeCl3 NH4Cl五种溶液只用一种试剂把它们区别开,这种试剂是( )
| A.氨水 | B.AgNO3 | C.浓NaOH | D.NaCl |
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )
①Fe ②NH4HCO3 ③Al2O3 ④Al(OH)3 ⑤Al
| A.①③④ | B.①③④⑤ | C.②③④⑤ | D.全部 |
若阿伏加德罗常数用NA表示,请回答下列问题:
(1).0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2).现有mg某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为____________L。
③该气体溶于水后形成VL溶液(不考虑反应),其溶液的物质的量浓度为___mol·L-1。
已知A经如下图所示的过程转化为D,,请回答下列问题:
(1) 若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。
③ D的浓溶液在加热下可与铜反应并生成B气体,请写出该反应的化学方程式
。指出该反应的氧化剂为 ,
还原产物为 反应中每生成1mol B气体,转移 mol电子。
(2)若A为金属单质,C是淡黄色固体,D为强碱
①写出C→D的化学方程式
该反应 (填“属于”、“不属于”)氧化还原反应。
实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需仪器除了玻璃棒、烧杯、胶头滴管 、量筒外,还需要哪个仪器才能完成该实验,请写出: 。
(2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(4)下列对容量瓶及其使用方法的描述中正确的是_____。
| A.容量瓶上标有容积、温度和浓度 |
| B.容量瓶用蒸馏水洗净后,必须烘干 |
| C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm处,改用胶头滴管加蒸馏水至刻度线 |
| D.使用前要检查容量瓶是否漏水 |
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中。
③转移前,容量瓶中含有少量蒸馏水。
④定容时,仰视刻度线。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装
成实验装置:(提示:在验证CO2之前须先除尽SO2)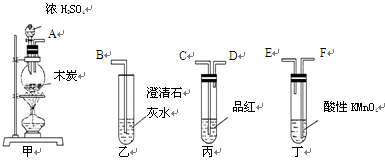
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
(共14分)右图中,A为空气中常见的气体单质、B、C、E是金属单质,D为非金属单质。已知:①I是一种常见的温室气体,E原子核内有12个质子②反应 能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
(1)分别写出F、G、H、I的化学式
F G H I
(2)书写下列化学方程式 ;
;
(3)C与NaOH溶液反应的化学方程式为 ,
反应后溶液与过量化合物I反应的化学方程式为 ;
⑷1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量为:
(提示 :2FeCl3 + Cu ==2FeCl2+ CuCl2);
 粤公网安备 44130202000953号
粤公网安备 44130202000953号