2012届高三上学期一轮复习化学单元验收试卷(4)(新人教版)
“神州七号”三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是 ( )
A. 质子数之比为1:2:3 B.中子数之比为1:1:1
质子数之比为1:2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
把钠放入滴有酚酞试液的水中,下列现象不会出现的是 ( )
| A.钠浮在水面上 | B.钠熔化成小球 |
| C.溶液中产生较多的气泡 | D.水溶液变成红色 |
下面关于Na2CO3和NaHCO3性质的叙述,不正确的是 ( )
| A.在水中的溶解度:碳酸钠>碳酸氢钠 |
| B.热稳定性:碳酸钠>碳酸氢钠 |
| C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少 |
| D.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生二氧化碳一样多 |
将一定量的金属钠放入一定物质的量浓度的NaOH溶液中,反应完成后,NaOH溶液的物质的量浓度 ( )
| A.增大 | B.不能确定 | C.减少 | D.不变 |
把金属钠2.3g溶于水中,要使所得溶液中,钠离子与水分子个数之比为1:100,则所需要水的质量是 ( )
| A.181.8g | B.180g | C.181.6g | D.220g |
如图所示,在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气 的成分仍不变。则钠和氧化汞的物质的量之比是( )
的成分仍不变。则钠和氧化汞的物质的量之比是( )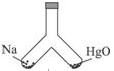
| A.1:1 | B.2∶1 | C.23∶216.6 | D.216.6∶23 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的体积的关系可表示为
下列叙述中,正确的是 ( )
| A.Na比K的金属性强 | B.Na和K的电子层数相同 |
| C.Na和K都是强还原剂 | D.Na和K灼烧时都能使火焰呈现紫色 |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 ( )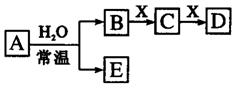
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A 是单质,B和D的反应是
是单质,B和D的反应是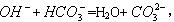 则E一定能还原Fe2O3C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
则E一定能还原Fe2O3C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
 D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
将含O2和CH4的混合气体充入装有23.4gNa2O2的密闭容器中点燃,反应结束后,容器温度为150℃,压强为0pa,将残留物溶于水无气体逸出。下列叙述正确的是( )
| A.原混合气体中O2和CH4的体积比为2:1 |
| B.原混合气体中O2和CH4的体积比为1:3 |
| C.残留固体中有Na2CO3和NaOH |
| D.残留固体中只有Na2CO3 |
多硫化钠Na2Sx(x>2) 在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反
在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反 应中Na2Sx与NaClO的物质的量之比为1︰16,则x的值是 ( )
应中Na2Sx与NaClO的物质的量之比为1︰16,则x的值是 ( )
| A.5 | B.4 | C.3 | D.2 |
甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L Na2CO3溶 液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为 ( )
液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为 ( )
| A.甲=乙 | B.甲>乙 | C.甲<乙 | D.无法确定 |
NaH是一种离子化合物,与水反应时生成烧碱和氢气,它也能和乙醇等反应产生氢气。下列关于NaH的叙述中正确的是 ( )
| A.与水反应时,水作氧化剂 |
| B.LiH中阳离子半径小于阴离子半径 |
| C.跟乙醇反应时,放出氢气的速度比跟水反应时更快 |
| D.与水反应时,生成的烧碱是还原产物 |
在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中,从这个实验过程观察到的反应现象中,不可能得出的结论是 ( )
| A.钠比较柔软 | B.钠与水反应生成碱 |
| C.钠与水反应放热 | D.钠与水反应放出气体 |
将4.6g钠放入95.4g水中, 所得溶液的质量分数是 ( )
A 等于4.6% B等于8% C 4.6% ~8% D 大于 8%
如下图带漏斗U型管中装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面a附近上下往复运动,下列说法不正确的是 ( )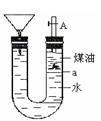
| A.此碱金属可能是钾或钠 |
| B.反应一段时间煤油会燃烧 |
| C.碱金属上下运动是由于与水反应产生了氢气 |
| D.若是金属锂则不能观察到上述现象 |
纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 。若其它操作不变,将A与C连接,可观察到的现象是 。

(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO 2,结晶,得到9.3 g白色固体,该白色固体的组成是 (写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
| 实验操作 |
实验现象 |
结论 |
|
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl 2溶液 |
|||
| ②过滤,取2 mL滤液于试管中 |
|||
| ③ |
|||
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:  k+s-5#u
k+s-5#u
已知NaHCO 3在低温下溶解度较小。反应I为:
NaCl+CO 2+NH 3+H 2O  NaHCO 3↓+NH 4Cl,处理母液的两种方法如下。
NaHCO 3↓+NH 4Cl,处理母液的两种方法如下。
①向母液中加入石灰乳,可将其中 循环利用,同时得到融雪剂 。
②向母液中通入NH 3,加入细小的食盐颗粒并降温,可得到NH 4Cl晶体。
试写出通入NH 3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:_______________________________________。
有人设计一个Na 2O 2与CO 2反应实验装置图如下:

打开止水夹,发现CO 2通过裹有Na 2O 2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na 2O 2与CO 2反应的结论是:
a:有氧气生成:b:
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。

请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①②进行实验,他测得的数据是 。按他测得的数据计算出的实验结果偏高,理由是 。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口  的连接顺序 。k+s-5#u
的连接顺序 。k+s-5#u
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w 1g和w 2g,则样品中碳酸钠的质量分数为 。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处 (若没有,此空不必回答;若有,请一并说出不足的理由)  。
。
(现有等物质的量的NaHCO3和KHCO3的混合物a g 与100mL盐酸反应,题中涉及的气体体积均以标准状况计,填空时可以用带字母的分式表示
(1)该混合物中NaHCO3和KHCO3的质量比是___________________________
(2)如碳酸氢盐和盐酸恰好完全反应,则盐酸的物质的量浓度为____________________
(3)如盐酸过量,生成CO2体积为______________________________________________
(4)如果反应后碳酸氢盐有剩 余,
余, 盐酸不足量,要计算生成CO2的体积,还需要知道_______________________
盐酸不足量,要计算生成CO2的体积,还需要知道_______________________ ______________________________________________
______________________________________________
(5)若NaHCO3和KHCO3不是以等物质的量的混合,则a g 混合物与足量的盐酸完全反应时生成CO2的体积范围是____________________________________________
标准状况下,向1 00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 k+s-5#u
k+s-5#u
已知图中B点位置固定,V(B)="300" ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 |
V(A)=0 |
0<V(A)<150 |
V(A)=150 |
150<V(A)<300 |
| 溶质的成分 |
① |
② |
③ |
④ |
(3)取V(A)="100" mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号