2020年全国统一高考理综试卷(全国Ⅰ卷)化学部分
国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳
紫花前胡醇( )可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
)可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
A.分子式为C14H14O4
B.不能使酸性重铬酸钾溶液变色
C.能够发生水解反应
D.能够发生消去反应生成双键
下列气体去除杂质的方法中,不能实现目的的是( )
气体(杂质) |
方法 |
|
A. |
SO2(H2S) |
通过酸性高锰酸钾溶液 |
B. |
Cl2(HCl) |
通过饱和的食盐水 |
C. |
N2(O2) |
通过灼热的铜丝网 |
D. |
NO(NO2) |
通过氢氧化钠溶液 |
A.AB.BC.CD.D
铑的配合物离子[Rh(CO) 2I 2] ﹣可催化甲醇羰基化,反应过程如图所示。下列叙述错误的是( )

A.CH 3COI是反应中间体
B.甲醇羰基化反应为CH 3OH+CO═CH 3CO 2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH 3OH+HI═CH 3I+H 2O
1934年约里奥﹣居里夫妇在核反应中用α粒子(即氦核 He)轰击金属原子 X,得到核素 Y,开创了人造放射性核素的先河: X He→ Y n其中元素X、Y的最外层电子数之和为8.下列叙述正确的是( )
A. X的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
科学家近年发明了一种新型Zn﹣CO 2水介质电池。电池示意图如图,电极为金属锌和选择性催化材料。放电时,温室气体CO 2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法错误的是( )

A.放电时,负极反应为Zn﹣2e ﹣+4OH ﹣═Zn(OH) 4 2 ﹣
B.放电时,1mol CO 2转化为HCOOH,转移的电子数为2mol
C.充电时,电池总反应为2Zn(OH) 4 2 ﹣═2Zn+O 2↑+4OH ﹣+2H 2O
D.充电时,正极溶液中OH ﹣浓度升高
以酚酞为指示剂,用0.1000mol•L ﹣ 1的NaOH溶液滴定20.00mL未知浓度的二元酸H 2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。[比如A 2 ﹣的分布系数:δ(A 2 ﹣) ]
下列叙述正确的是( )

A.曲线①代表δ(H 2A),曲线②代表δ(HA ﹣)
B.H 2A溶液的浓度为0.2000mol•L ﹣ 1
C.HA ﹣的电离常数K a=1.0×10 ﹣ 2
D.滴定终点时,溶液中c(Na +)<2c(A 2 ﹣)+c(HA ﹣)
钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。采用如图工艺流程可由黏土钒矿制备NH 4VO 3。
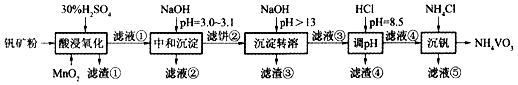
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
金属离子 |
Fe 3+ |
Fe 2+ |
Al 3+ |
Mn 2+ |
开始沉淀pH |
1.9 |
7.0 |
3.0 |
8.1 |
完全沉淀pH |
3.2 |
9.0 |
4.7 |
10.1 |
回答下列问题:
(1)"酸浸氧化"需要加热,其原因是 。
(2)"酸浸氧化"中,VO +和VO 2+被氧化成VO 2 +,同时还有 离子被氧化。写出VO +转化为VO 2 +反应的离子方程式 。
(3)"中和沉淀"中,钒水解并沉淀为V 2O 5•xH 2O,随滤液②可除去金属离子K +、Mg 2+、Na +、 ,以及部分的 。
(4)"沉淀转溶"中,V 2O 5•xH 2O转化为钒酸盐溶解。滤渣③的主要成分是 。
(5)"调pH"中有沉淀生产,生成沉淀反应的化学方程式是 。
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
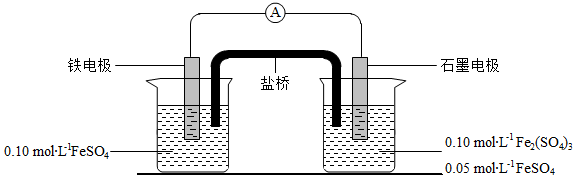
回答下列问题:
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
Na + |
5.19 |
NO 3 ﹣ |
7.40 |
Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO 2的催化氧化:SO 2(g) O 2(g) SO 3(g)△H=﹣98kJ•mol ﹣ 1.回答下列问题:
(1)钒催化剂参与反应的能量变化如图(a)所示,V 2O 5(s)与SO 2(g)反应生成VOSO 4(s)和V 2O 4(s)的热化学方程式为: 。
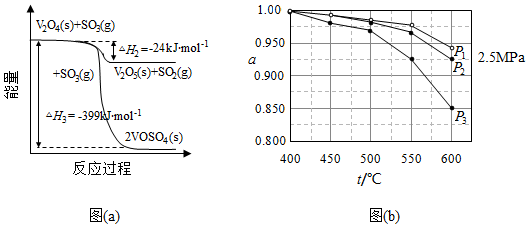
(2)当SO 2(g)、O 2(g)和N 2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO 2平衡转化率α随温度的变化如图(b)所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(3)将组成(物质的量分数)为2m% SO 2(g)、m% O 2(g)和q% N 2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO 2转化率为α,则SO 3压强为 ,平衡常数K p= (以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO 2催化氧化的反应速率方程为:v=k( 1) 0.8(1﹣nα′)式中:k为反应速率常数,随温度t升高而增大;α为SO 2平衡转化率,α′为某时刻SO 2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度t m.t<t m时,v逐渐提高;t>t m后,v逐渐下降。原因是 。
Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe 2+与Fe 3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I 1)如表所示。I 1(Li)>I 1(Na),原因是 。 I 1(Be)>I 1(B)>I 1(Li),原因是 。
I 1/(kJ•mol ﹣ 1) |
||
Li 520 |
Be 900 |
B 801 |
Na 496 |
Mg 738 |
Al 578 |
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO 4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO 4的单元数有 个。
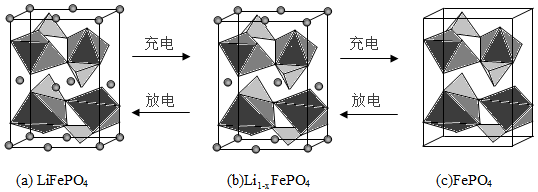
电池充电时,LiFePO 4脱出部分Li +,形成Li 1 ﹣ xFePO 4,结构示意图如(b)所示,则x= ,n(Fe 2+):n(Fe 3+)= 。
有机碱,例如二甲基胺(  )、苯胺(
)、苯胺( 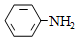 )、吡啶(
)、吡啶(  )等,在有机合成中应用很普遍,目前"有机超强碱"的研究越来越受到关注。以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前"有机超强碱"的研究越来越受到关注。以下为有机超强碱F的合成路线:

已知如下信息:
①H 2C=CH 2
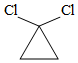
② 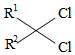 +RNH 2
+RNH 2

③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为 。
(2)由B生成C的化学方程式为 。
(3)C中所含官能团的名称为 。
(4)由C生成D的反应类型为 。
(5)D的结构简式为 。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的有 种,其中,芳香环上为二取代的结构简式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号