2016年河南省中考化学试卷
下列物质的用途中,利用其化学性质的是( )
| A. |
铜用于制作电线 |
B. |
金刚石用来切割大理石 |
| C. |
干冰用于人工降雨 |
D. |
熟石灰用来改良酸性土壤 |
下列化肥中,属于复合肥料的是( )
| A. |
CO(NH 2) 2 |
B. |
KNO 3 |
C. |
K 2SO 4 |
D. |
Ca 3(PO 4) 2 |
下列有关水的说法中正确的是( )
| A. |
水与冰块混合得到混合物 |
| B. |
水的蒸发和水通电分解都属于物理变化 |
| C. |
硬水是指含有较多可溶性钙、镁化合物的水 |
| D. |
水沸腾时可冲起壶盖,说明温度升高分子会变大 |
下列各组物质中,都由离子构成的一组是( )
| A. |
NaCl、CuSO 4 |
B. |
CH 4、HCl |
C. |
Si、CO 2 |
D. |
Ar、Au |
如图是甲、乙的溶解度曲线,下列说法不正确的是( )

| A. |
t 1℃时,乙的溶解度大于甲的溶解度 |
| B. |
t 2℃时,甲、乙饱和溶液中溶质质量分数相等 |
| C. |
降低温度能使接近饱和的甲溶液变为饱和溶液 |
| D. |
t 3℃时,75g甲的饱和溶液中加入50g水,可以得到质量分数为25%的溶液 |
下列化学方程式中符合题意且书写正确的是( )
| A. |
正常雨水偏弱酸性原因:SO 2+H 2O═H 2SO 4 |
| B. |
生活中用天然气作燃料:C 2H 3OH+3O 2 2CO 2+3H 2O |
| C. |
用小苏打治疗胃酸过多症:NaHCO 3+HCl═NaCl+CO 2↑+H 2O |
| D. |
工业上用熟石灰制取烧碱:Ca(OH) 2+2NaNO 3═Ca(NO 3) 2+2NaOH |
偏二甲肼(C 2H 8N 2)与N 2O 4反应放出的能量能把火箭送入太空,该化学方程式为C 2H 8N 2+2N 2O 4═2X↑+3N 2↑+4H 2O↑,下列说法正确的是( )
| A. |
X的化学式为CO |
| B. |
偏二甲肼中碳的质量分数为40% |
| C. |
该反应属于分解反应 |
| D. |
生成N 2和H 2O的质量比为14:9 |
X、Y、Z有如图所示的转化关系("→"表示反应一步实现,部分物质和反应条件已略去),则符合要求的X、Y、Z依次为( )

| A. |
Cu、CuO、Cu(OH) 2 |
B. |
C、CO、H 2CO 3 |
| C. |
CaO、Ca(OH) 2、CaCO 3 |
D. |
H 2O 2、H 2、H 2O |
相同质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气质量(直接用各金属表示)大小关系有以下几种猜测:①Mg>Al>Zn;②Al>Mg>Zn;③Al=Mg=Zn;④Al=Mg>Zn;⑤Al=Zn>Mg;⑥Al>Mg=Zn.其中合理的个数为( )
| A. |
5个 |
B. |
4个 |
C. |
3个 |
D. |
2个 |
如图是元素周期表中的一格,氖的相对原子质量为 ,其原子结构示意图为 ,该元素在元素周期表中位于第二周期的 (填"最左边"、"中间"或"最右边")。

如图是某反应的微观示意图,其化学方程式为 ;以上反应生成的酸能与碱中和,如果将Cl 2通入到石灰乳中可制取漂白粉[有效成分Ca(ClO) 2],化学方程式为 .

葡萄糖酸锌(C12H22O14Zn)中所含人体必需的微量元素是 .2015年诺贝尔奖获得者屠呦呦发现的青蒿素是一种抗疟疾药,若14.1g青蒿素燃烧生成33.0gCO2和9.9gH2O,则青蒿素中氧的质量与其燃烧消耗氧气的质量之比为 .
为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。

(1)X的成分为 ;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和 。
(2)加入B时反应的化学方程式为 。
(3)操作Ⅱ中玻璃棒的作用是 。
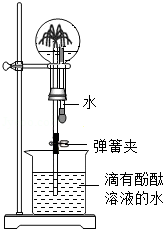
以下是有关氨气(NH 3)性质的趣味实验.
(1)如图圆底烧瓶中充满氨气,当挤压胶头滴管并打开止水夹时,烧杯中的水迅速进入烧瓶,形成"红色喷泉",推测氨气具有哪些性质?
(2)氨气与酸反应可生成铵盐.将分别蘸有浓氨水和浓盐酸的玻璃棒接近(不接触),就有大量白烟产生,请解释白烟产生的原因.
如图是实验室制取气体的常用装置。
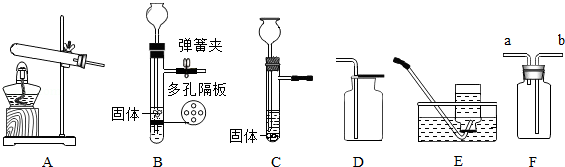
(1)实验室用KMnO 4制取O 2应选用的一套装置为 (填字母代号);该反应的化学方程式为 。
(2)B或C装置均可作制取CO 2的发生装置,B的优点是能控制反应的发生和停止,请简述使B装置中反应停止的原理。
(3)若用如图F装置采用排水法收集H 2,请简述操作步骤。
除去NaCl溶液中CaCl 2、MgCl 2、Na 2SO 4杂质的操作有:①加入过量的NaOH溶液,②加入过量的BaCl 2溶液,③过滤,④加适量的盐酸;⑤加过量的Na 2CO 3溶液。
(1)以上操作合理的而先后顺序为 (数字序号不能重复使用)。
(2)请写出BaCl 2溶液与Na 2CO 3溶液反应的化学方程式。
(3)上述试剂中的Na 2CO 3不能用K 2CO 3代替,请说明原因。
生活中常见物质的性质、制法的是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 (填"单质"或"化合物")。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
(4)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物。

①B装置玻璃管里可观察到的现象为 。
②C装置中反应的化学方程式为 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na 2CO 3溶液呈碱性)
(5)工业上可利用"铝热反应"焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?

 闻气体气味
闻气体气味 称固体质量
称固体质量 读液体体积
读液体体积 稀释浓硫酸
稀释浓硫酸 粤公网安备 44130202000953号
粤公网安备 44130202000953号