2018年广东省深圳市中考化学试卷
下列化学用语表达正确的是( )
A.三个钡离子:3Ba2+
B.两个氧原子:O2
C.四个硫酸根离子:4SO32﹣
D.五个一氧化碳分子:5Co
6月5日是世界环境日,2018年我国的主题是“美丽中国,我是行动者”。下列做法错误的是( )
A.减少使用不必要的塑料制品,如用布袋代替塑料袋
B.节约用水提高水的使用效益,如用洗过菜的水浇花
C.养成将垃圾分类处理的习惯,如废旧报纸回收利用
D.过度施用农药化肥提高产量,如喷洒过量农药杀虫
归纳总结是学习化学的重要方法之一。下列排序正确的是( )
A.金属活动性顺序:
B.溶液的pH:
C.地壳中的元素含量:
D.气体的密度:
下列说法正确的是( )
A.将pH试纸直接浸入待测液中测其pH
B.能与盐酸反应生成CO2气体的盐一定是NaHCO3
C.铁制品锈蚀是铁在潮湿空气中缓慢氧化的过程
D.在测定空气里氧气含量的实验中,红磷燃烧产生大量白雾
锌是促进人体生长发育的必须微量元素。如图为锌元素在元素周期表中的相关信息及原子结构示意图。下列说法正确的是( )
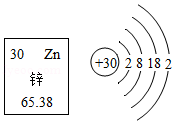
A.锌属于非金属元素
B.锌原子的中子数为30
C.锌的相对原子质量为65.38g
D.锌原子在化学反应中易失去电子形成Zn2+
维生素可以起到调节新陈代谢、预防疾病、维持身体健康的重要作用。缺乏维生素A1(C20H30O),会引起夜盲症。下列关于维生素A1的说法中正确的是( )
A.维生素A1属于无机物
B.维生素A1中O元素的质量分数最低
C.维生素A1中碳、氢元素的质量比为2:3
D.维生素A1由20个碳原子、30个氢原子、1个氧原子构成
最近,我国科学家成功合成新型催化剂,将CO2高效转化为甲醇(CH3OH)。这不仅可以缓解碳排放引起的温室效应,还将成为理想的能源补充形式。该化学反应的微观过程如图所示。下列说法正确的是( )

A.该反应中四种物质均为化合物
B.反应前后H元素的化合价不变
C.参加反应的甲、乙分子个数比为1:3
D.反应前后原子数目发生改变
甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是( )

A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
下列方法不能达到除杂的目的是( )
选项 |
物质(括号内为杂质) |
方法 |
A |
N2(O2) |
将混合气体通过灼热铜网 |
B |
Fe粉(炭粉) |
加入足量稀H2SO4充分反应,过滤,洗涤,干燥 |
C |
CaO(CaCO3) |
高温煅烧 |
D |
FeCl2溶液(CuCl2) |
加入足量Fe粉,过滤 |
A.AB.BC.CD.D
图为A~G(初中常见物质)的转化关系,其中A是天然气的主要成分。

根据以上信息回答下列问题:
(1)写出A 的化学式: ,其常见用途为 (任写一条)。
(2)反应①的现象为 。
(3)写出反应②的化学方程式 ,该反应属于 反应(填基本反应类型)。
(4)写出反应③的化学方程式 。
(5)Na2O与CaO的化学性质相似,下列物质中 (填标号)能与Na2O发生化学反应。
a.Mg b.N2 c.稀盐酸 d.NaCl固体
小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。

①写出用H2O2溶液制备O2的化学方程式: 。
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为 B → → E (填标号)。为了确保实验成功,在装药品之前应该 。
③检验O2的方法是 ,若木条复燃,则证明收集的气体为O2。
(2)FeCl3溶液做催化剂
向5mL5%的H2O2溶液中加入2滴一定浓度的 FeCl3溶液,立即产生大量气泡。
[已知]FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl﹣
[问题]那种微粒对H2O2溶液的分解起催化作用?
[假设]假设一:可能是H2O
假设二:可能是Fe3+
假设三:可能是Cl﹣
[解析]①假设一不可能成立,理由是 。
[实验]
操作 |
现象 |
其他条件不变,向H2O2溶液中加入NaCl溶液 |
无明显变化 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 |
无明显变化 |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 |
立即产生大量气泡 |
[结论]②假设 成立,而假设一和另一种假设不成立。
(3)催化剂比较
从循环利用的角度分析, (填化学式)更适合做该反应的催化剂。
(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。
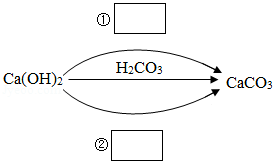
(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
 属于化学变化B.
属于化学变化B. 净化后可得纯水
净化后可得纯水 证明水的组成D.
证明水的组成D. 吸收大量热
吸收大量热 粤公网安备 44130202000953号
粤公网安备 44130202000953号