2016年福建省宁德市中考化学试卷
液化石油气可压缩储存于钢瓶中,这是因为( )
| A. |
分子质量减小 |
B. |
分子在不断运动 |
| C. |
分子自身体积变小 |
D. |
分子之间有间隔 |
二氧化钛(TiO 2)是一种白色无机颜料,则TiO 2中钛元素的化合价为( )
| A. |
+1 |
B. |
+2 |
C. |
+3 |
D. |
+4 |
镁有"国防金属"的美誉。在元素周期表中,镁元素的信息如图所示,对图中信息解释错误的是( )
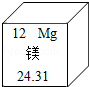
| A. |
原子序数为12 |
B. |
属于金属元素 |
| C. |
元素符号为Mg |
D. |
相对原子质量为24.31g |
下列不利于人体健康的是( )
| A. |
用氮气给食品保鲜 |
| B. |
制作馒头时加适量小苏打 |
| C. |
霉变大米制米粉 |
| D. |
适量食用加碘盐 |
葡萄糖(C 6H 12O 6)为人体活动和维持体温提供所需的能量,下列说法正确的是( )
| A. |
一个葡萄糖分子含有12个氢分子 |
| B. |
葡萄糖属于六大营养素中的糖类 |
| C. |
葡萄糖中氢元素的质量分数最大 |
| D. |
葡萄糖中碳、氢、氧元素的质量比为1:2:1 |
下列与中和反应无关的是( )
| A. |
酸中的H +和碱中的OH ﹣结合生成H 2O |
| B. |
用稀盐酸清洗铁锈 |
| C. |
中和反应过程中伴随着能量的变化 |
| D. |
恰好完全反应时,溶液pH为7 |
如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )

| A. |
t 1℃时甲、乙两种物质的溶解度相等 |
| B. |
t 2℃时,30g甲物质加入到50g水中充分溶解,得到80g饱和溶液 |
| C. |
要从甲物质的饱和溶液中获得晶体甲,可以采用升高温度的方法 |
| D. |
t 3℃时乙的饱和溶液不能再溶解任何物质 |
将a、b、c三种金属分别投入稀盐酸中,只有b溶解并产生气泡;把a和c分别放入硝酸银溶液中,在a表面有银析出,c没有变化。则a、b、c三种金属可能是( )
| A. |
Fe、Cu、Ag |
B. |
Cu、Ag、Fe |
C. |
Cu、Zn、Ag |
D. |
Ag、Zn、Cu |
下列设计的实验方案中(括号中为所选试剂),你认为不可行的是( )
| A. |
检验某天然水是硬水还是软水(肥皂水) |
| B. |
鉴别固体氢氧化钠、氯化钠、硝酸铵(水) |
| C. |
干燥湿润的氧气(生石灰) |
| D. |
除去氧化铜粉末中的炭粉(稀硫酸) |
化学与生产、生活息息相关。
(1)水稻生长初期需要施氮肥,下列属于氮肥的是 。
A.K 2CO 3 B.(NH 4) 2SO 4 C.Ca 3(PO 4) 2 D.CO(NH 2) 2
(2)农业上常用溶质质量分数为16%的氯化钠溶液选种,现要配制100Kg这种溶液,需要 Kg氯化钠,配制该溶液的主要步骤有:①计算 ②称量 ③量取 ④ 。
(3)自行车是"绿色出行"的交通工具,为防止其链条生锈常采用的方法是 ;自行车支架使用的铝合金是 材料(填"金属"或"合成"),铝离子结构示意图如图 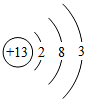 ,铝在化学反应中易 (填"得"或"失")电子,她的离子符号为 。
,铝在化学反应中易 (填"得"或"失")电子,她的离子符号为 。
能源是人类活动的物质基础,清洁能源和可再生能源具有广阔的开发与应用前景。
(1)物质R是一种可再生绿色能源,其燃烧的化学方程式为R+3O 2 2CO 2+3H 2O,则R中含有的元素是 。
(2)氢气是理想的清洁、高效燃料。现有制备氢气新工艺的主要流程如下:

①"设备Ⅰ"中的反应在常温下进行,该制备氢气新工艺的主要优点是 。
②"设备Ⅱ"是太阳能电池电解器,氧化铝在该设备中发生化学反应,该反应的化学方程式是 。
甲、乙、丙皆为初中化学常见物质,有如图所示的转化关系("→"表示转化关系其它物质和反应条件已略去)。
(1)如果甲是固态非金属元素的单质,乙、丙是该元素的氧化物,其中丙是植物光合作用的原料。
①则乙是 (填化学式),实现甲→乙的基本反应类型是 。
②乙、丙的位置 (填"能"或"不能")互换。
(2)如果甲为碳酸钠、乙为碱、丙为氧化物。则丙是 (填化学式),写出一个甲→乙的化学方程式: 。

化学是一门以实验为基础的学科
[实验一]常见气体的制取

(1)仪器a的名称 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),反应的化学方程式为 。
(3)实验室用A装置制取氧气,从燃烧条件分析,加热过程中试管内的棉花没有燃烧的原因是 。
[实验二]对比归纳是学习化学的重要方法

(4)实验A:观察到图2②中反应更剧烈,可知影响硫燃烧剧烈程度的因素是 。
(5)实验B:观察到图3 ④中固体消失,③中固体几乎不溶,可知影响物质溶解性的因素是 。
二氧化碳与二氧化硫均为非金属氧化物,某兴趣小组用类比法对SO 2进行如下探究:
探究一 二氧化硫和二氧化碳性质的比较
[查阅资料]二氧化硫具有漂白性,能与某些有色物质(如品红溶液)反应生成无色物质。

操作现象装置 |
实验Ⅰ:通入二氧化碳 |
实验Ⅱ:通入二氧化硫 |
A |
紫色变成红色 |
? |
B |
无明显变化 |
红色褪为无色 |
C |
白色浑浊 |
白色浑浊 |
由实验可知:
(1)将SO 2通入装置A中的现象为 说明二氧化硫也能与水反应生成相应的酸。
(2)二氧化碳能与澄清石灰水反应,生成亚硫酸钙(CaSO 3)和水,写出该反应的化学方程式 。
(3)鉴别CO 2和SO 2的方法是 。
(4)从环保角度指出上述装置的不足之处: 。
探究二 测定工业废气中的SO 2含量
[查阅资料]①二氧化硫与溴水反应的化学方程式为:Br 2+SO 2+2H 2O=H 2SO 4+2HBr
②我省规定工业排放的废气中SO 2含量不得超0.4mg/m 3。
探究小组进行如下实验
测定步骤:
Ⅰ.向试管中加入10mL溶质的质量分数为0.1%的溴水(其密度可近视看做1g/cm 3)
Ⅱ.在指定地点抽取工业废气注入上述溴水中(如图2)。
Ⅲ.当注入溴水中的工业废气总量达5m 3时,溶液恰好由黄色变成无色。
(1)由实验可知该废气中SO 2含量为 mg/m 3, (填"符合"或"不符合")排放标准(SO 2、Br 2的相对分子质量分别为:64、160)
(2)排放到空气中的SO 2气体主要来自 的燃烧。
 倾倒液体
倾倒液体 闻气味
闻气味 点燃酒精灯
点燃酒精灯 过滤
过滤
 粤公网安备 44130202000953号
粤公网安备 44130202000953号