2017年北京市中考化学试卷
下列做法中,不符合"尊重自然、自觉践行绿色生活"倡议的是( )
| A. |
人走关灯、少开空调 |
B. |
使用一次性餐具 |
| C. |
自带水杯出行 |
D. |
对垃圾进行分类 |
铬在元素周期表中信息如图所示,下列有关铬元素的说法正确的是( )

| A. |
原子序数是24 |
| B. |
属于非金属元素 |
| C. |
一个铬原子核外有28个电子 |
| D. |
相对原子质量为52.00g |
下列方法能区分氧气和二氧化碳两瓶气体的是( )
| A. |
闻气味 |
| B. |
观察颜色 |
| C. |
倒入适量氢氧化钠溶液 |
| D. |
将燃着的木条伸入集气瓶中 |
土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物 |
花生 |
苹果 |
西瓜 |
沙枣 |
适宜的pH范围 |
5.0~6.0 |
5.0~6.5 |
6.0~7.0 |
8.0~8.7 |
| A. |
花生 |
B. |
苹果 |
C. |
西瓜 |
D. |
沙枣 |
硅是信息技术的关键材料。高温下氢气与四氯化硅(SiCl 4)反应的化学方程式为:2H 2+SiCl 4 Si+4HCl,该反应属于( )
| A. |
化合反应 |
B. |
分解反应 |
C. |
置换反应 |
D. |
复分解反应 |
下列关于物质用途的描述不正确的是( )
| A. |
氧气可用作燃料 |
| B. |
二氧化碳可用作气体肥料 |
| C. |
干冰可用于人工降雨 |
| D. |
铜丝可用作导线 |
如图为尿素【CO(NH2)2】中各元素质量分数的示意图,其中表示氮元素质量分数的是( )

| A. |
① |
B. |
② |
C. |
③ |
D. |
④ |
用"W"型玻璃管进行微型实验,如图所示。下列说法不正确的是( )

| A. |
a处红棕色粉末变为黑色 |
| B. |
a处的反应为CO+Fe 2O 3═2Fe+CO 2 |
| C. |
b处澄清石灰水变浑浊证明有CO 2生成 |
| D. |
可利用点燃的方法进行尾气处理 |
依据实验和溶解度曲线回答16~19题.

25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解.
①中溶液的质量为( )
| A. |
10g |
B. |
90g |
C. |
100g |
D. |
110g |
依据实验和溶解度曲线回答16~19题.

25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解.
上述溶液为饱和溶液的是( )
| A. |
②③④ |
B. |
②④ |
C. |
③④ |
D. |
④ |
依据实验和溶解度曲线回答16~19题.

25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解.
能将不饱和KCl溶液变为饱和KCl溶液的方法是( )
| A. |
升高温度 |
B. |
加水 |
| C. |
加KCl固体 |
D. |
倒出部分溶液 |
依据实验和溶解度曲线回答16~19题.

25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解.
④中溶液的溶质质量分数约为( )
| A. |
26% |
B. |
29% |
C. |
35% |
D. |
40% |
实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化。测定结果如图所示。下列说法不正确的是( )

| A. |
反应过程中有热量放出 |
| B. |
30s时,溶液中溶质为HCl和NaCl |
| C. |
该实验是将稀盐酸滴入稀NaOH溶液 |
| D. |
从20s到40s,溶液的温度升高、pH增大 |
葡萄的果肉和果皮中都含有丰富的营养物质。
(1)为使葡萄果实饱满、提高含糖量,在葡萄生长的中后期可适当施加硫酸钾、过磷酸钙等肥料,其中硫酸钾属于化学肥料中的 肥。
(2)用硫酸铜配制的农药波尔多液,可以防治葡萄生长中的病害。溶解硫酸铜时不宜用铁制容器,用化学方程式表示其原因: 。
(3)食用葡萄前要清洗干净,如图是一种清洗的方法。 
下列说法正确的是 (填序号)。
| A. |
面粉有利于去除葡萄皮上的脏东西 |
| B. |
清洗干净后,建议吃葡萄不吐葡萄皮 |
| C. |
葡萄富含糖类物质,糖尿病人不宜多食。 |
太阳能吸附式制冷结露法空气取水器可用于野外获取淡水,工作原理如图所示。
(1)蒸发冷凝器中发生的是 (填“物理”或“化学”)变化。
(2)吸附剂中主要物质为SiO2和CaCl2,SiO2中硅元素的化合价为 ,CaCl2中钙、氯元素的质量比为 。

2017年5月我国海域可燃冰试采获得成功。可燃冰(天然气水合物)是资源量丰富的高效清洁能源,能释放出天然气。
(1)生活中,可以利用天然气(主要成分是甲烷)获得热量。甲烷燃烧的化学方程式为 。
(2)工业上,可以利用甲烷获得氢气,其反应的微观示意图如图:

①图1所示反应的化学方程式为 。
②在图2横线处补全相应微粒的图示。
载人航天器工作舱中的空气要与地球上的空气基本一致。
资料:在同温同压下,气体的体积之比等于分子个数之比。
(1)用微观示意图表示工作舱中空气的主要成分,图中最合理的是 (填序号)。

(2)宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为 。
(3)航天器返回地面后,用Ca(OH)2与Li2CO3发生复分解反应,使 (填化学式)再生。
阅读下面科普短文。
说起二氧化硫(SO2),你可能首先想到它是空气质量播报中提及的大气污染物。其实你真的了解SO2吗?难道它只是有害物质吗?
SO2与食品工业
SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业。葡萄酒酿制中适量添加SO2,可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动。食糖加工过程中可使用SO2进行脱色。按照我国《食品添加剂使用标准(GB2760﹣2014)》,合理使用SO2不会对人体健康造成危害。
标准中部分食品SO2的最大残留量
食品 |
蜜饯 |
葡萄酒 |
食糖 |
水果干 |
巧克力 |
果蔬汁 |
最大残留量 |
0.35g/kg |
0.25g/L |
0.1g/kg |
0.1g/kg |
0.1g/kg |
0.05g/kg |
SO2与硫酸工业
硫酸是重要的化工原料,工业制硫酸的关键步骤是SO2的获取和转化。工业利用硫制硫酸的主要过程示意如下:

硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨。工业上可先用氨水吸收,再用硫酸处理,将重新生成的SO2循环利用。
SO2与化石燃料
化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2.为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量,改进燃烧技术”的措施,例如,对燃煤进行脱硫、固硫处理;还可以采取“优化能源结构、减少燃煤使用”的措施,例如,北京大力推广的“煤改气、煤改电”工程,有效改善了空气质量。
现在,你对SO2一定有了新的认识,在今后的化学学习中你对SO2还会有更全面的认识!
依据文章内容回答下列问题。
(1)按照国家标准,食糖中的SO2最大残留量为 g/kg。
(2)葡萄酒酿制过程中SO2的作用是 。
(3)用硫制硫酸的主要过程中,涉及到的含硫物质有S、 和H2SO4。
(4)硫酸工业生产中,吸收尾气中SO2的物质是 。
(5)下列措施能减少SO2排放的是 (填序号)。
A.将煤块粉碎
B.对燃煤进行脱硫
C.推广煤改气、煤改电
D.循环利用工业尾气中的SO2。
超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
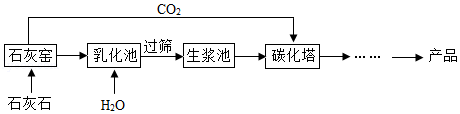
(1)石灰石主要成分的化学式为 。
(2)乳化池中,生石灰与水发生反应,其化学方程式为 。
(3)过筛的目的是拦截 (填“大于”或“小于”)筛孔直径的颗粒。
(4)碳化塔中反应的化学方程式为 。
工业上用硫铁矿烧渣(主要成分是Fe3O4、Fe2O3等)、煤粉作原料制备FeCO3的主要流程如图:
(1)焙烧炉中,发生的主要反应为:
①3C+2O2 2CO+CO2
②Fe2O3+CO 2FeO+CO2
③Fe3O4+CO 3FeO+CO2
上述反应中的各物质,碳元素呈现 种化合价.
(2)酸浸槽中,FeO转化为FeSO4,加入的物质X是 .
(3)主反应器中,生成FeCO3的反应物为 .
如图为“领取奖杯游戏”的物质阶梯.当阶梯上相邻的物质之间能发生反应,方可向上攀登.例如,攀登阶梯甲能领取奖杯.

(1)认识阶梯甲
①阶梯上的5种物质中,属于氧化物的是 ,俗称纯碱的是 .
②攀登过程中,H2SO4与Na2CO3发生反应的化学方程式为 .
(2)搭建阶梯乙
请你从O2、Fe、Fe2O3、HCl、NaOH中选择4种物质,写在图中相应的台阶上,能领取奖杯.
(3)共享物质、重塑阶梯
阶梯乙搭建完成后,若在阶梯甲和阶梯乙中各选择一种物质进行互换,也均能领取奖杯,则这两种物质是 (任写一组即可).
如图所示,电子秤上的量筒中分别盛有蒸馏水、浓硫酸,放置一段时间。
(1)A中示数变小,从微粒的角度解释其原因是 。
(2)B中示数 (填“变大”“不变”或“变小”),其原因是 。

如图所示,在白色点滴板1﹣6的孔穴中,分别滴加2滴紫色石蕊溶液。
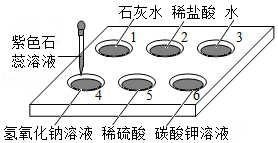
(1)孔穴6中溶液变为蓝色,说明碳酸钾溶液显 (填"酸性"或"碱性")。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3)作为空白对照实验的孔穴是 。
(4)再向孔穴4中滴加稀硫酸,溶液变为紫色,用化学方程式解释其原因: 。
利用如图所示装置进行实验。

(1)打开K1,观察到蜡烛 ;A中发生反应的化学方程式为 。
(2)关闭K1、打开K2,观察到蜡烛缓慢的熄灭。蜡烛熄灭的原因是 。
请从A或B两题中任选一个作答,若两题均作答,按35﹣A计分.
A用浓硫酸配制100g 9.8%的稀硫酸 |
B粗盐中难溶性杂质的去除 |
(1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有 (填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是 . |
(1)过滤需要用到的仪器有 (填序号). (2)蒸发过程中,需不断进行搅拌,其原因是 . |
可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 |
|
如图所示,调节杠杆平衡.

(1)实验1:通入CO 2一段时间后,活性炭包下沉,原因是 .
(2)实验2:加热细铜丝团一段时间后移走酒精灯,观察到铜丝变为黑色(CuO),细铜丝团 (填"上升"或"下沉").
(3)实验3:一段时间后,铁粉包下沉,是因为铁粉与 发生反应.
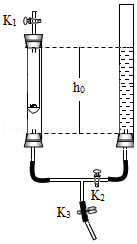
利用下图装置进行实验(两支玻璃管内径相同).实验前K 1、K 2、K 3均已关闭。
实验装置 |
【实验1】制备气体 |
【实验2】测定空气中氧气含量 |
|
左管中带孔的燃烧匙盛有足量锌粒,右管盛有稀硫酸 Ⅰ.打开K 1和K 2,使反应发生 Ⅱ.在K 1的导管口处收集气体 Ⅲ.… |
左管中燃烧匙盛有足量白磷,右管盛有水 Ⅰ.光照引燃白磷 Ⅱ.待白磷熄灭,冷却,打开K 2,至液面不再变化,右管中液体的高度为h 1 |
(1)实验1:锌与稀硫酸反应的化学方程式为 ;为使反应停止,Ⅲ中的操作是 。
(2)实验2:打开K 2,右管中液面下降,原因是 ;计算空气中氧气体积分数的表达式为 (用h 0、h 1表示)。
高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。
Ⅰ.不稳定性
(1)如图所示进行实验,KMnO 4受热分解的化学方程式为 ,3.16g KMnO 4产生O 2的质量为 g。
(2)用向上排空气法收集O 2的原因是 。
Ⅱ.腐蚀性
[查阅资料]KMnO 4溶液呈中性、有腐蚀性
[进行实验]
实验1:将新鲜鸡皮在不同浓度的KMnO 4溶液中浸泡相同时间,现象如表
KMnO 4溶液浓度 |
0.002% |
0.01% |
0.1% |
1% |
鸡皮的变化 |
无明显变化 |
边缘部分变为棕黄色 |
全部变为棕色 |
全部变为黑色 |
实验2:将铜片分别浸泡在4种浸泡相同时间,现象如下表。
编号 |
① |
② |
③ |
④ |
|
实验 |
25mL0.1%KMnO 4溶液 |
25mL0.1%KMnO 4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO 4溶液+10滴浓硫酸 |
|
铜片 质量/g |
实验前 |
0.54 |
0.54 |
0.54 |
0.54 |
18小时后 |
0.54 |
0.52 |
0.54 |
0.43 |
|
[解释与结论]
(3)实验1的目的是 。
(4)实验2中通过对比②和④,得出的结论是 。
(5)实验2中,欲得出"KMnO 4和硫酸共同作用对铜才有腐蚀性"的结论,需要对比 (填编号) 。
(6)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。
5Cu+2KMnO 4+8H 2SO 4=5CuSO 4+2MnSO 4+K 2SO 4+ 。






 粤公网安备 44130202000953号
粤公网安备 44130202000953号