2011年普通高等学校招生全国统一考试化学卷(新课标)
下列叙述正确的是
| A. | 1.00 中含有6.02×10 23个 分子 |
| B. | 1.00 中,所有 的最外层电子总数为8×6.02×10 23 |
| C. | 欲配置1.00 ,1.00 . 的 溶液,可将58.5 溶于1.00 水中 |
| D. | 电解58.5 熔融的 ,能产生22.4 氯气(标准状况)、23.0 金属钠 |
分子式为的同分异构体共有(不考虑立体异构)()
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
下列反应中,属于取代反应的是
①
②
③
④
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
将浓度为0.1溶液加水不断稀释,下列各量始终保持增大的是()
| A. | B. |

|
C. |

|
D. |

|
铁镍蓄电池又称爱迪生电池,放电时的总反应为:下列有关该电池的说法不正确的是()
| A. | 电池的电解液为碱性溶液,正极为 、负极为 |
| B. | 电池放电时,负极反应为 |
| C. | 电池充电过程中,阴极附近溶液的 降低 |
| D. | 电池充电时,阳极反应为 |
能正确表示下列反应的离子方程式为

 +
+
短周期元素、、和的原子序数依次增大.元素W是制备一种高效电池的重要材料,原子的最外层电子数是内层电子数的2倍,元素是地壳中含量最丰富的金属元素,原子的最外层电子数是其电子层数的2倍.下列说法错误的是
| A. | 元素 、 的氯化物中,各原子不是均满足8电子的稳定结构 |
| B. | 元素 与氢形成的原子个数比为1:1的化合物有1种 |
| C. | 元素 的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D. | 元素 可与元素 形成共价化合物 |
0.80•5样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。

请回答下列问题:
(1)试确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与在加热时发生反应的化学方程式为
(4)在0.10·硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的=8时,()=
若在0.1·硫酸铜溶液中通入过量气体,使完全沉淀为,此时溶液中的浓度是
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知、和的燃烧热分别为-285.8、-283.0和-726.5。请回答下列问题:
(1)用太阳能分解10水消耗的能量是;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3)在溶积为2的密闭容器中,由和合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:均大于300℃);

下列说法正确的是(填序号)
温度为时,从反应开始到平衡,生成甲醇的平均速率为
②该反应在时的平衡常数比时的小
③该反应为放热反应
④处于点的反应体系从变到,达到平衡时增大
(4)在温度时,将1和3充入一密闭恒容器中,充分反应达到平衡后,若转化率为,则容器内的压强与起始压强之比为;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为、正极的反应式为。理想状态下,该燃料电池消耗1甲醇所能产生的最大电能为702.1,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组长拟选用如下装置制备氢化钙。

请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞(请按正确的顺序填入下列步骤的标号)。
| A. | 加热反应一段时间 | B. | 收集气体并检验其纯度 |
| C. | 关闭分液漏斗活塞 | D. | 停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有生成。
① 写出与水反应的化学方程式
②该同学的判断不正确,原因是
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是。
普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸表面涂覆明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂覆明矾的工艺有关,其中的化学原理是
(2)为了保护这些纸质文物,有人建议采取下列措施。
1喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是
2喷洒.可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法
(1)现代造纸工艺常用钛白粉() 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分),为原料按下过程进行的,请 完成下列化学方程式
完成下列化学方程式
 ①
①
 ②
②
氮化硼()是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到和,如下图所示:

请回答下列问题:
(1)由制备、的化学方程式依次是、;
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是,中B元素的化合价为;
(3)在分子中,的建角是,B原子的杂化轨道类型为,和过量作用可生成,的立体结构为;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5,立方氮化硼晶苞中含有各氮原子、各硼原子,立方氮化硼的密度是(只要求列算式,不必计算出数值,阿伏伽德罗常数为)。
香豆浆是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
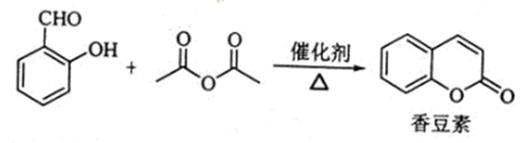
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
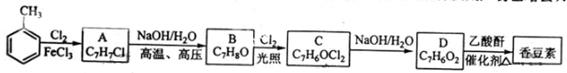
已知以下信息:
① A中有五种不同化学环境的氢
② B可与溶液发生显色反应
③ 同一个碳原子上连有连个羧基通常不稳定,易脱水形成羧基。
请回答下列问题:
(1) 香豆素的分子式为;
(2) 由甲苯生成A的反应类型为;A的化学名称为
(3) 由B生成C的化学反应方程式为;
(4) B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中只出现四组峰的有种;
(5) D的同分异构体中含有苯环的还有中,其中:
① 既能发生银境反应,又能发生水解反应的是(写解构简式)
② 能够与饱和碳酸氢钠溶液反应放出的是(写解构简式)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号