贵州省遵义市高三上学期第一次联考化学试卷
用NA表示的值,下列说法正确的是
| A.24.5L氢气中所含氢原子数一定大于2NA |
| B.lmolCH3+电子数为9NA |
| C.l00g 60%CH3COOH水溶液中含有的分子数为NA |
| D.常温常压下0.lmol CO和NO的混合气体含氧原子数为0.lNA |
下列离子方程式的书写正确的是
| A.Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH- +H++SO42—=BaSO4 ↓+H2O |
| B.AlCl3溶液中加入过量氨水:Al3++3NH3.HO=Al(OH)3↓ +3NH4+ |
| C.将Na投入到CuSO4溶液:2Na+Cu2+= 2Na++Cu |
| D.等物质的量的MgCl2、NaOH和HC1溶液混合:Mg2++2OH一=Mg(OH)2↓ |
下列说法正确的是
| A.SO2、NO、SiO2都是酸性氧化物 |
| B.PM2.5是指大气中直径接近于2.5×l0 -6m的颗粒物,它在空气中形成气溶胶 |
| C.向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化 |
| D.KCl和SO3溶于水后均能导电,是因为KC1和SO3都为电解质 |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.水溶液中:Na+、K+、NO3— |
| B.空气中:CO2、SO2、NO |
| C.氢氧化铁胶体中:H+、K+、I— |
| D.高锰酸钾溶液中:H+、SO42—、CH3CH2OH |
金属在人类社会的发展进程中起着重要的作用。下列有关金属及其化合物的说法正确的是
| A.Fe、Mg、Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 |
| B.Fe在高温下能与水蒸气反应,Fe被氧化生成Fe2O3,H2O被还原生成H2 |
| C.鉴别Na2CO3和NaHCO3溶液可向两种溶液中加入Ba(OH)2溶液,产生沉淀的就是Na2CO3 |
| D.Al与NaOH溶液的反应中,NaOH既不是氧化剂又不是还原剂 |
关于有机物的说法不正确的是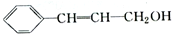
| A.lmol该有机物可以和4molH2反应 |
| B.该有机物分子中所有碳原子不可能共面 |
| C.该有机物可使溴的四氯化碳溶液褪色 |
| D.该有机物含有两种官能团 |
已知还原性Cl-< Br-< Fe2+<I-,氧化性Cl2>Br2>Fe3+> I2,则下列说法正确的是
| A.在含有Br、Fe2+、I-的溶液中欲只氧化I-而不氧化Br、Fe2+,可用FeBr3作试剂 |
| B.向FeI2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++ Cl2=2Fe3++ 2C1- |
| C.向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2+ +2Br-+2Cl2=2Fe3++ Br2+4Cl- |
| D.向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++ I2=2Fe3++ 2I- |
某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
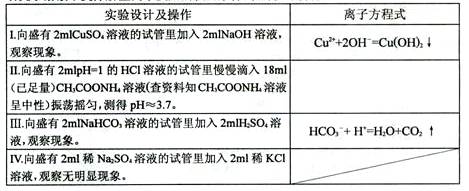
①写出II实验中发生反应的离子方式: 。
②根据实验发现只要有 等物质生成,水溶液中复分解型离子反应就可以发生。
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些____ 的方向进行(与溶液混合的瞬间相比)。
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释: 。
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2CO3、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。____ 、____ 。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:___ _。反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为 mol,转移电子的物质的量为 mol。
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________。
| A.缩小容器容积 |
| B.及时分离出Y、Z |
| C.使用合理的催化剂 |
| D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:______________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_____________。
铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:___________________。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制得Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:______________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因:__________。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:_________________________。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和NaSO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示:

①写出(a+10)到(a+20)过程中反应的离子方程式:_____________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)=mol
粗铜精炼后的阳极泥含有Cu、Au(金)、Pb和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e一=Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为_____________过滤、洗涤、干燥,操作II的名称是 。
(4)写出用SO2还原AuCl4一的离子方程式______________________。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法_____________________。
(6)已知常温时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)= 1.82×l0-8,用离子方程式表示加入碳酸钠溶液的作用____________________________。
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因:________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为____,B与N之间形成 键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。

化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环且苯环上有2种化学环境氢。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8%,含氢7.0%,核磁共振氢谱显示只有一个峰。

已知:
请回答下列问题:
(1)写出G的分子式: 。
(2)写出A的结构简式: 。
(3)写出F—→G反应的化学方程式: ,该反应属于 (填反应类型)。
(4)写出满足下列条件的C的所有同分异构体的结构简式: 。
①是苯的对位二取代化合物;
②能与FeCI3溶液发生显色反应;
③不考虑烯醇 结构。
结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式 (只要写出1种)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号