北京市西城区高三二模试卷(理综)化学部分
下列有关生活中化学的叙述,不正确的是 ( )
| A.加碘食盐能使淀粉溶液变蓝 |
| B.钢铁在海水中比在河水中更易生锈 |
| C.严禁乱弃废电池,防止重金属污染土壤和水源 |
| D.向高硫煤中加入生石灰,可减少燃煤对大气的污染 |
下列有关物质制备的说法中,不正确的是 ( )
| A.用油脂和烧碱制肥皂过程中有水解反应 |
| B.用电石和水反应制乙炔是氧化还原反应 |
| C.用NH4Cl和熟石灰反应制氨气是复分解反应 |
| D.用饱和FeCl3溶液制Fe(OH)3胶体是水解反应 |
下列依据相关数据作出的推理和判断中,不正确的是 ( )
| A.依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| B.依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| C.依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D.依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
下列实验能达到预期目的的是 ( )
①用溴水验证汽油中含有不饱和烃
②用NaOH溶液除去苯中混有的少量苯酚
⑧用醋酸和澄清石灰水验证蛋壳中含有碳酸盐
④用饱和NaHC03溶液除去CO2中混有的少量HCl
| A.只有①②③ | B.只有①②④ | C.只有②③④ | D.①②③④ |
25℃时,KW=1.0×10-14;100℃时,KW=5.5×10-13。下列说法正确的是 ( )
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/LNaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
下列有关工程塑料PBT(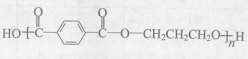 )的说法中,正确的是( )
)的说法中,正确的是( )
| A.PBT是加聚反应得到的高分子化合物 |
| B.PBT分子中含有羧基、羟基和酯基 |
| C.PBT的单体中有芳香烃 |
| D.PBT的单体均能与Na、NaOH、Na2CO3反应 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
A.反应I2(aq)+I-(aq) I3-(aq)△H>0 I3-(aq)△H>0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1 |
C.若T1时,反应进行到状态d时,一定有 |
| D.状态a与状态b相比,状态b时I2的转化率更高 |
A、B、D、E、Y为5种短周期元素。
①A、B、D位于同一周期,D、Y位于同一主族。A的原子的最外层电子数是其次外层电子数的2倍。
②D的氢化物是最常用的溶剂,E的单质是一种生活中常见的金属。
请回答:
(1)AD2中具有的化学键的类型是 。
(2)高温时,6 gA的单质与D的气态氢化物反应,生成两种还原性气体,吸收的热量为65.75 kJ,其反应的热化学方程式是 。
(3)D与氢元素可组成含有10个电子的X一,与X一组成元素相同,原予数个数比也相同的分子的电子式是 。
(4)将盛有一定量红棕色气体BD2的4L容器压缩至2L,待气体颜色不再变化时,容器内的压强(填“大于”、“等于”或“小于”) 原来的2倍,原因是 。
(5)E的某种化合物可用作净水时的混凝剂,其原理是(用离子方程式表示) 。
(6)YD2气体通入足量BaCl2和B的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是 。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
已知: ①Al3+、Al(OH)3、AlO2-有如下转化关系:
②碳酸不能溶解Al(OH)3。
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4,并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是 。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是 。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是 。
某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究。
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为 。
。
| 序号 |
V(H2SO4)/mL |
C(H2SO4)/mol·L-1 |
t/s |
| I |
40 |
1 |
t1 |
| II |
40 |
4 |
t2 |
比较实验I和Ⅱ可以得出的实验结论是 。
实验过程中,对量气管的操作是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
由苯合成香料K和解热镇痛药物G的路线如下:
注:以上反应中R、R’、R”均表示烃基
(1)芳香烃A中C、H原子数之比是4:5,l mol A:在氧气中完全燃烧生成8 mol CO2,A的分子式是 ;A分子中只有7个碳原子一定共平面,A的结构简式是 。
(2)B的结构简式是 。
(3)E→F的反应类型是 。
(4)D→E反应的化学方程式是 。
(5)K与新制Cu(OH)2悬浊液反应的化学方程式是 。
(6)G与(5)中反应的有机产物互为同分异构体,含有相同的官能团,且位置与F中官能团的位置相同,G的结构简式是 。
(7)K的同分异构体W,其分子内苯环上的氢原子只有1种,且仅含有2个甲基。l mol W最多与3 mol饱和溴水反应,则W的1种结构简式是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号