2011年江苏省宿迁市泗洪县中考化学模拟试卷
化学无所不在,生活离不开化学.家用热水瓶通常使用饮木塞,当装入或取用开水,需将饮木塞放在桌面上时,运用你所学的知识分析软木塞应怎样放置?简要说明理由.(2分)
下图能正确表示环境监测人员描绘的某城市中心地区CO含量变化曲线的是____;理由是____;请你就此现象提出一条你的设想或建议:____.(6分)
有①镊子、②烧杯、③试管、④胶头滴管、⑤药匙、⑥燃烧匙、⑦坩蜗钳、⑧10mL量筒、⑨100mL量筒、⑩托盘天平等仪器.(4分)
请为下列实验操作各选一种仪器(填写相应的序号):
吸取或滴加少量液体时用____;可以直接在酒精灯火焰上加热的玻琉仪器是____;硫在氧气中燃烧的实验用____;量取8mL的水用____.
如右图所示装置可用于收集氧气,请回答下列问题.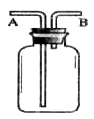
(1)用向上排空气法收集氧气,则氧气应从____端导管通入,空气由____排出.若要检查已收集满氧气,可将带火星的木条放在____端导管口处;
(2)若用排水法收集氧气,可使集气瓶中装满水,氧气从____端导管通入,水从____端导管排出.
根据下图所示实验,并阅读小资料,回答下列问题.
(1)图1中反应的化学方程式为____,集气瓶中加入液体的作用是____.
(2)图2中的反应现象为____,集气瓶中加入的液体可能是____,其目的为____.
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如下图的实验装置.假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
(1)实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明:____;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹.可观察到的现象为:____;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却.可观察到的现象为:____;
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败.例如:____.
某硝酸铵化肥的外包装如右图.请根据包装上的标签计算:
(1)NH4NO3的相对分子质量____
(2)NH4NO3中各元素的原子个数比____
(3)通过计算判断此氮肥样品是纯净物还是混合物.(要求有计算过程)
某品牌厨房清洁剂,经测定其pH约为13。对该清洁剂的酸碱性判断正确的是
| A.呈酸性 | B.呈碱性 | C.呈中性 | D.无法判断 |
鉴别空气、氧气和二氧化碳三瓶气体,最常用的方法是
| A.分别测定它们的密度 |
| B.将气体分别通入紫色石蕊溶液中 |
| C.观察颜色并闻它们的气味 |
| D.将燃着的木条分别伸入集气瓶中 |
水被烧开时,壶盖被顶起,说明
| A.分子是由原子构成的 | B.分子的质量很小 |
| C.分子的体积变大 | D.分子间空隙增大 |
下列实验现象描述正确的是
| A.磷在氧气中燃烧产生大量白烟 |
| B.硫在氧气中燃烧火焰呈淡蓝色 |
| C.铁丝在空气中剧烈燃烧,火星四射 |
| D.木炭在空气中燃烧生成二氧化碳 |
右图是元素周期表中碘元素的信息,下列说法正确的是
| A.该元素的质子数为53 |
B.该元素的原子序数为126.9 |
| C.该元素在地壳中的含量为53% |
| D.该元素属于金属元素 |
下列化学方程式书写正确的是
A.4P+5O2 2P2O5 2P2O5 |
B.H2O2 H2↑+O2↑ H2↑+O2↑ |
| C.2Fe+3CuSO4 ===Fe2(SO4)3+3Cu | D.CH4+2O2 CO2+2H2O CO2+2H2O |
2010年5月1日,上海世博会开幕。本届世博会的主题是“城市,让生活更美好” 为了这一主题倡导“低碳经济,绿色出行”,下列生产、生活中的一些做法中不符合这一主题的是:
| A.提倡低碳生活,大力发展低碳产业,以减轻温室效应 |
| B.购物时减少使用或不用塑料袋,以减少“白色污染” |
| C.为防止电池污染土壤和水体,在分类回收的同时,积极开发废旧电池的综合利用技术 |
| D.开发利用太阳能等清洁能源来代替化石燃料,同时禁止使用化石燃料 |
现代社会的生产和生活要消耗大量能量,下列活动中,通过化学反应提供能量的是
| A.发射航天飞机 | B.水车汲水灌溉 | C.太阳能供热 | D.风力发电 |
下列说法不正确的是
| A.水银不是银而是汞 | B.有机玻璃不是玻璃是塑料 |
| C.玻璃钢不是玻璃而是钢 | D.纯碱不属于碱而属于盐 |
下列关于实验现象的描述不正确的是
| A.铁丝在空气中燃烧火星四射,生成黑色固体 |
| B.硫在空气中燃烧发出淡蓝色的火焰 |
| C.家庭小实验中,将食醋与纯碱混合有大量气泡产生 |
| D.将生铁粉末投入盛有过量盐酸的烧杯中,充分反应后仍有黑色残渣 |
肾病患者需要食用低钠盐的食品,目前市场供应的低钠盐多为苹果酸钠盐 (C4H5O5Na)。下列有关苹果酸钠的说法不正确的是
A.苹果酸钠由4种元素组成
B.苹果酸钠中C、H、O、Na的原子个数比为4∶5∶5∶1
C.苹果酸钠中C、H两种元素的质量比为48∶5
D.苹果酸钠中氧元素的质量分数为33.3%
二氧化氯(ClO2)已被世界卫生组织确认为一种安全、高效的强力杀菌剂,制取二氧化氯的反应是:
2NaClO3+4HCl(浓)  Cl2↑+2ClO2↑+2NaCl+2X,则X的化学式是
Cl2↑+2ClO2↑+2NaCl+2X,则X的化学式是
| A.H2O | B.H2 | C.O2 | D.HCl |
通过如下实验,判断金属X、Y、Z的活动顺序。将金属X、Y、Z分别投入足量的稀硫酸中,只有X、Z能发生反应,并放出氢气。将Z投入X的硝酸盐溶液中,有金属X产生。X、Y、Z的活动顺序为
| A.X>Z>Y | B.Z>X>Y | C.Z>Y>X | D.Y>Z>X |
玻璃棒是常用的实验仪器。下列实验中需要使用玻璃棒的是
①蒸发 ②稀释浓硫酸 ③量取10毫升水
④用固体溶质配制一定溶质质量分数的溶液
| A.只有①② | B.只有①④ | C.只有①②④ | D.①②③④ |
下列除杂的实验过程都正确的是(括号内为杂质)
| A.KCl(K2CO3)加足量稀硫酸、过滤、蒸发、结晶 |
| B.BaSO4(BaCO3)加足量稀盐酸、过滤、洗涤、干燥 |
| C.CO2(HCl)先通过氢氧化钠溶液,后通过浓硫酸 |
| D.MnO2 (KCl)加水溶解、过滤、蒸发、结晶 |
下列图像中有关量的变化趋势与对应叙述关系正确的是
| A.向一定质量盐酸中加镁粉至过量 |
| B.向一定质量的稀硫酸中滴加水 |
| C.向盐酸和氯化铜的混合溶液中滴加氢氧化钠溶液至过量 |
| D.高温煅烧一定质量的石灰石 |
下列说法正确的是:
| A.凡是跟碱反应生成盐和水的物质一定是酸 |
| B.用蒸馏或煮沸的方法能降低水的硬度 |
| C.在无色溶液中滴入酚酞试液,溶液变红色,该溶液一定是碱溶液 |
| D.可用过滤的方法从氯化钠溶液中获得氯化钠晶体 |
下表中 代表氢原子,
代表氢原子, 代表氧原子,
代表氧原子,  代表碳原子,则下列有关说法正确的是:
代表碳原子,则下列有关说法正确的是:
| A.物质①的相对分子质量为2g |
| B.物质②是单质 |
| C.物质③中氧元素质量分数最大 |
| D.物质③,④虽然分子结构不相同,但相对分子质量相同 |
化学与生活、社会密切相关。下列说法不正确的是
| A.适当摄入水果蔬菜和富含蛋白质的肉类,有利于增强体质 |
| B.食用甲醛浸泡的海产品,可提高人体免疫力 |
| C.富含淀粉的食物可以用碘水或碘酒来检验 |
| D.利用硝酸铵溶于水吸热的原理,自制冰袋给发烧病人降温 |
用正确的化学符号填空。
(1) 1个氦原子 ▲ ; (2)2个氮分子 ▲ ;
(3) 3个铵根离子 ▲ ; (4)氯化钠中氯元素的化合价 ▲ 。
化学就在我们身边,它能改善我们的生活。请从以下物质中选择适当的序号填空:①氧气 ②一氧化碳 ③大理石 ④小苏打 ⑤熟石灰 ⑥葡萄糖
(1) 发酵粉可以使食品松软可口,属于发酵粉成分之一的是 ▲ ;
(2) 常用来改良酸性土壤的是 ▲ ;
(3) 医院为病人输液补充能量的物质是 ▲ ;
(4) 吸烟对人体有害。燃着的香烟产生的烟气中含有一种能与血液中血红蛋白结合的有毒气体,它是 ▲ 。
下表为KCl在不同温度下的溶解度:
| 温度╱℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 溶解度╱g |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
(1) 由上表可推测KCl溶解度随温度的升高而___▲_____(填“增大”或“减小”)。
(2) 在10℃时,向100 g水中加入40g KCl固体,充分混合后所得溶液为____▲____(填“饱和”或“不饱和”)溶液;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为________▲___(计算结果精确到0.1%)。
(3) 将60℃时145.5gKCl的饱和溶液降温到40℃,析出晶体的质量是 ____▲_____ g。
甲醇(CH3OH)是一种无色透明有挥发性的的液体,有毒性,能损坏神经。以前是用木材干馏制取,所以称为木醇或木精。现在是用CO与H2在一定条件下大规模生产的。依据上述知识回答下列问题:
(1) 木材干馏制木精属于 ▲ 变化;
(2) 写出甲醇的一条物理性质 ▲ ;
(3) 写出生产甲醇的化学方程式 ▲ ;
(4) 工业酒精中含有甲醇,能否用工业酒精兑酒出售? ▲
有关物质的转化关系如右图所示,其中X、Y为两种气态单质,Z为固态单质;A为最简单的有机化合物,B、C、D为三种状态各不相同的氧化物(个别反应的条件未注明)。回答下列问题(已知高温下CO和金属氧化物反应与CO和Fe2O3的反应相类似):
(1) 写出有关物质的化学式:A ____▲_____ 、Y ___▲_____;
(2) 反应①、② 、③、④中属于置换反应的为_____▲________(填序号)。
(3) 写出反应③的化学方程式_______________▲_______________;
(4) 若向图中的浅绿色溶液中加入硝酸银溶液,能产生不溶于稀硝酸的白色沉淀,则E物质的名称为_________▲__________ 。
现有如图所示的实验装置。回答问题:
(1)仪器①的名称是 ▲ ,检验B装置气密性方法是 ▲ 。
(2)实验室用氯化铵固体和熟石灰混合物共热制取氨气,所得氨气极易溶于水,氨气有刺激性气味,水溶液呈碱性,相同状况下,此气体的密度比空气小,欲制备并收集氨气所选用的装置依次是▲ 。亮亮同学认为此种方法收集氨气不妥,你认为他的理由可能是 ▲ 。
(3)质量分数为3%的医用双氧水在常温下难分解;但在双氧水溶液中加入铁锈,就会迅速分解,且反应结束后过滤出的铁锈可重复使用。试写出该反应的化学方程式 ▲
发生装置可选用 ▲ (填写序号);用该发生装置还可以制取的气体是_ ▲ 。(从学过的气体中选择)
(4)某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如下图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。
①仪器乙的作用是 ▲ 。
②若装置中没有连接仪器乙,将使该塑料试样中氢元素的质量测算结果 ▲ (填“偏小”、“偏大”、“无影响”)。
③如果将丁和戊两装置位置调换,你认为 ▲ (填“可以”或“不可以”)理由是 ▲ 。
物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象。某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是: ▲ 。
(2)简述强调“测得的pH小于7”的理由: ▲ 。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”目的是 ▲ ,“滴入植物油”目的是 ▲ 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈 ▲ 性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:
①实验方法:做对比实验,取上述NaOH溶液加水稀释,加入酚酞溶液,观察到 ▲ ,说明是由于氢氧化钠溶液浓度过大而出现的上述现象。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
(1)表中x = ▲ 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据 ▲ 判断NaOH溶液与稀盐酸发生了中和反应。







 粤公网安备 44130202000953号
粤公网安备 44130202000953号