上海市奉贤区九年级上学期11月调研测试化学试卷
近日,北方多个城市再遭雾霾侵袭,雾霾可使空气中增加大量的
| A.二氧化碳 | B.一氧化碳 | C.可吸入颗粒物 | D.二氧化硫 |
二氧化钛(TiO2)可作水分解的光催化剂,其中氧元素为 -2价,则钛元素的化合价为
| A.+1 | B.+2 | C.+3 | D.+4 |
下列物质的化学式书写正确的是
| A.氖气—Ne2 | B.一氧化碳Co | C.氧化铁—Fe2O3 | D.氯化钠—NaCl2 |
用打气筒可将空气压入自行车胎内,这是由于
| A.分子之间有间隔 | B.分子可以分成原子 |
| C.分子在不断运动 | D.分子的体积非常小 |
下列对化学式NO2的各种表述中,错误的是
| A.表示一个二氧化氮分子 |
| B.表示二氧化氮这种物质 |
| C.表示二氧化氮中,氮元素与氧元素的质量比为7∶8 |
| D.表示一个二氧化氮分子由一个氮原子和两个氧原子构成 |
用氯酸钾制氧气时,造成试管破裂的原因可能是
①没有给试管均匀预热;②试管外壁潮湿;③试管口没有略微向下倾斜;④排水法收集完氧气,先撤酒精灯。
| A.①②③④ | B.①②③ | C.②③④ | D.②④ |
试管在化学实验中常与其他仪器和药品同时使用(图中其他仪器和药品略去)。下列试管的朝向与实验项目相对应且正确的是
| A.加热氯酸钾制氧气 | B.向试管中加入粉末状药品初始阶段 |
| C.排空气法收集氧气 | D.给液体加热 |
下图表示三种物质在密闭容器中反应前后质量比例的变化,下列说法正确的是
| A.该反应中CaO起催化作用 | B.该反应中CO2是生成物 |
| C.该反应是分解反应 | D.该反应是化合反应 |
测定空气中氧气含量的实验装置如右图所示,下列说法正确的是
| A.实验中产生大量白雾 |
| B.燃烧匙中的红磷可以换成木炭 |
| C.本实验可以证明空气含有N2、O2、CO2和稀有气体 |
| D.选用过量红磷是因为反应可以耗尽氧气,生成固态的P2O5 |
关于“摩尔”的说法正确的是
| A.摩尔是一个物理量 | B.摩尔就是物质的量 |
| C.摩尔是物质的量的单位 | D.摩尔是表示物质数量的单位 |
宏观、微观和符号之间建立联系是化学学科的特点。
(1)请用适当的化学符号填空:
①汞的元素符号是 (1) ;②2个硝酸根 (2) ;
③填充飞艇的稀有气体是 (3) ;④引起酸雨的主要气体是 (4) ;
⑤生理盐水中的溶质是 (5) ;⑥石灰水检验二氧化碳气体 (6) 。(用化学方程式)
(2)关于反应2CO + O2  2CO2的读法或意义中,正确的是 (7) 。
2CO2的读法或意义中,正确的是 (7) 。
| A.一氧化碳加氧气点燃等于二氧化碳 |
| B.一氧化碳和氧气在点燃条件下反应生成二氧化碳 |
| C.每2个一氧化碳分子与1个氧分子反应生成2个二氧化碳分子 |
| D.2g一氧化碳和1g氧气在点燃条件下反应生成2g二氧化碳 |
今年10月,我国女科学家屠呦呦因发现青蒿素而获得诺贝尔奖。青蒿素(C15H22O5)是一种用于治疗疟疾的药物,由 (8) 种元素组成,分子中C、H、O原子物质的量之比为 (9) ,2mol青蒿素中约含 (10) 个氧原子(用科学计数法表示)。
生命离不开水,生活中也离不开水:
①水是常用的溶剂,这说明水具有 (11) 性质;
②我们生活中最常用的是自来水,下图是课本中“自来水厂生产流程图”:

“步骤五”中加入的氯起到的作用是 (12) ,其原理是:Cl2+H2O→HClO+X,则X的化学式为 (13) ;此反应中属于氧化物的是 (14) (填化学式),含有游离态氯元素的物质是 (15) (填化学式)。
该图中有一处标注不尽合理,请指出并说出你的理由是 (16) 。
③水分子在一般条件下很稳定,写出水在通直流电时发生的化学反应方程式: (17) ,下图A是电解水实验装置,a管中产生的气体是 (18) 。从微观角度分析,下图B中发生变化的是 (19) 。

实验室常用下列装置制取气体,请根据所学知识回答。
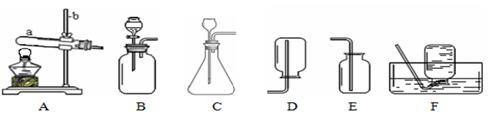
(1)写出图中仪器名称:a (1) ;b (2) 。
(2)实验室用A装置制取氧气
Ⅰ.反应的化学方程式为 (3) ,搭建A装置时,酒精灯应在固定仪器a之 (4) (选填“先”或“后”)放置。
Ⅱ.图中可以收集氧气的装置有 (5) (填装置编号)。
Ⅲ.从反应后的剩余固体中回收二氧化锰的操作是 (6) 。
(3)实验室在常温下用块状电石与水反应制取乙炔气体,该反应必须严格控制加水速度,以免引起发生装置炸裂。上图中最适合制取乙炔气体的发生装置是 (7) (填装置编号)。
同学们探究“影响实验室用过氧化氢溶液制取氧气反应速率的因素”,过程如下:
(1)对已有化学知识和生活经验的思考:
| 化学知识和生活经验 |
思考 |
| 木炭在氧气中燃烧比在空气中更旺 |
双氧水的浓度可能会影响生成氧气的快慢 |
| 夏天,将食品放在冰箱里不容易腐烂 |
(8) |
(2)根据上述思考设计了如下实验:
| 组别 |
温度 |
二氧化锰的质量 |
双氧水的浓度和体积 |
观察产生气泡的速率 |
| 1 |
室温 |
0.5g |
5%、50 mL |
反应平稳,有大量气泡产生 |
| 2 |
加热 |
0.5g |
w%、50 mL |
气泡急速产生,并产生大量白雾 |
| 3 |
室温 |
0.5g |
30%、50 mL |
气泡呈爆发式产生,并带出反应液 |
① 实验2中双氧水的浓度(w %)以 (9) 为宜。
② 通过比较 (10) 两组实验,可③以得到“浓度越大,化学反应越快”的结论。
③ 实验结论:第 (11) 组方案比较适合在实验室制取氧气。
④ 通过分析思考,影响化学反应速率的因素可能还有 (12) 。(写出一条)
实验小组欲测定双氧水中过氧化氢的物质的量。
【设计原理】将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,再通过方程式计算,得到过氧化氢的量。(“碱石灰”是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽)
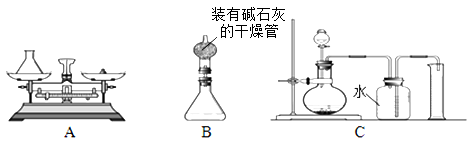
【过程方法】
(1)组长首先设计(如图A):向装有样品溶液的锥形瓶中投入二氧化锰,待双氧水完全反应完毕后测得产生氧气的质量是9.6g,则制取氧气为 (13) mol,双氧水中含过氧化氢多少mol?(写出具体计算过程) (14) 。
(2)小林对组长的设计提出质疑,在组长方案的锥形瓶上加一装有碱石灰的干燥管(如图B),然后再操 作,请说明小林质疑的理由是 (15) 。
(3)若用C装置来制取氧气并测得氧气的体积,此处的收集方法是 (16) 法,收集到氧气的体积约等于 (17) 。
 ”和“
”和“ ”表示不同元素的原子,以下图示表示混合物的是
”表示不同元素的原子,以下图示表示混合物的是








 粤公网安备 44130202000953号
粤公网安备 44130202000953号