江西省抚州市教研室高一上学期期末考试化学试卷
国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血。”这里的铁是指
A.铁单质 B.铁元素 C.四氧化三铁 D.硫酸铁
环保部2010年9月5日报导:目前全国约五分之一的城市大气污染严重,机动车排放成为部分大中城市大气污染的主要来源。下列大气污染物主要不是来自汽车尾气的是
| A.氯气 | B.一氧化氮 | C.一氧化碳 | D.碳氢化合物 |
下图是广州亚运会开幕式中广州塔上正在燃放的焰火,这些五彩缤纷的焰火与元素的焰色反应有关。下列说法错误的是
| A.钠盐在灼烧时火焰呈黄色 |
| B.单质钾与KCl在灼烧时火焰颜色相同 |
| C.可以用焰色反应来区别NaCl和KCl |
| D.焰色反应是化学变化 |
2010年11月14日,全球超级计算机500强排行榜在美国公布,中国天河一号超级计算机以每秒2570万亿次的实测运算速度,成为世界运算最快的超级计算机。计算机芯片的主要材料是硅,下列有关硅及化合物的说法正确的是
| A.单质硅具有良好的导电性能 |
| B.光导纤维的主要成份是二氧化硅 |
| C.二氧化硅是H2SiO3的酸酐,因此能与水反应,也能与碱溶液反应 |
| D.硅酸盐是由二氧化硅与金属氧化物组成的混合物 |
下列物质放置在空气中均易变质,不是因为发生氧化还原反应而变质的是
A.FeSO4 B.Na2O C.Na2O2 D.Na2SO3
将SO2通入显红色的酚酞试剂中,发现红色消失,这主要是因为SO2
A.有漂白性 B.有还原性
C.溶于水后显酸性 D.有氧化性
除去括号内杂质所用试剂和方法不正确的是
| A.NaCl溶液(碘)---CCl4,萃取,分液 | B.Cu(Fe)--- 加盐酸,过滤 |
| C.乙醇(NaCl)---蒸馏 | D.CO2(HCl)---氢氧化钠溶液,洗气 |
将Al分别加入到溶液质量相同且足量的稀盐酸和烧碱溶液中 ,当产生等质量的气体时,下列说法不正确的是
,当产生等质量的气体时,下列说法不正确的是
A.反应中消耗铝的质量相同 B.反应中转移的电子数相同
C.反应中消耗的HCl与NaOH物质的量相同 D.溶液增加的质量相同
2010年10月1日18时59分57秒,“嫦娥二号”卫星发射升空。嫦娥二号用的火箭的一子级和二子级使用偏二甲肼和N2O4作为推进剂,反应式为:(CH3)2NNH2+2N2O4=2CO2+4H2O+3N2 ,三子级则使用效能更高的液氢(H2)和液氧(O2)。下列说法正确的
| A.N2O4在反应中被氧化 | B.反应中1molN2O4得到4mole- |
| C.(CH3)2NNH2具有还原性 | D.液氢与液氧的反应中转移的电子数为2NA |
下列有关判断的依据不正确的是
A.氧化还原反应:反应中是否有元素化合价的升降 |
| B.电解质:在水溶液里或熔融状态下能导电的化合物 |
C.胶体:分散系中分散质粒子直径是否在1nm—100nm之间 |
| D.碱性氧化物:氧化物是否为金属氧化物 |
在酸性溶液中能大量共存,并且溶液为无色透明的离子组是
| A.Na+、K+、SiO32-、SO42- | B.NH4+、Na+、NO3-、Cl- |
| C.K+、Ca2+、HCO3-、Cl- | D.Mg2+、K+、Cl-、MnO4― |
表示下列反应的离子方程式正确的是
| A.醋酸溶液与氢氧化钠溶液反应:H++OH-= H2O |
| B.盐酸与碳酸钙反应:CO32-+2H+= CO2↑+H2O |
| C.向氯化亚铁溶液中通入氯气:2Fe2++ Cl2 = 2Fe3++2Cl- |
| D.铁和稀硝酸的反应: Fe+2H+= Fe2++H2↑ |
下列实验过程中,始终无明显现象的是
A .KSCN溶液加入Fe2(SO4)3溶液中 B.CO2通入CaCl2溶液中
.KSCN溶液加入Fe2(SO4)3溶液中 B.CO2通入CaCl2溶液中
C.N H3通入AlCl3溶液中 D.SO2通入用盐酸酸化的Ba(NO3)2溶液中
H3通入AlCl3溶液中 D.SO2通入用盐酸酸化的Ba(NO3)2溶液中
向浓度相同的Al2(SO4)3、MgSO4、(NH4)2SO4溶液中,加入等体积等浓度的BaCl2溶液时,恰好使上述三种溶液中SO42-全部沉淀,则Al2(SO4)3、MgSO4、(NH4)2SO4三种盐溶液的体积之比为
| A.1:2:3 | B.3:2:1 | C.1:3 :3 :3 |
D.3:1:1 |
下列试剂的实验室保存方法不正确的是
| A.钠保存在盛有煤油的广口瓶中 |
| B.氢氧化钠溶液保存在磨口塞的细口瓶中 |
| C.浓硝酸保存在棕色的细口瓶中,并置于低温阴暗处 |
| D.硫酸亚铁溶液中应加入适量的还原铁粉,并密闭保存 |
有一充有20mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12mL无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)
| A.2∶3 | B.3∶2 | C.1∶4 | D.4∶1 |
(8分)亚硝酸钠(NaNO2)是一种工业用盐,有像食盐一样的咸味,常被误食 引起中毒。已知强酸HI与NaNO2反应生成碘单质和一氧化氮气体,其化学方程式为:
引起中毒。已知强酸HI与NaNO2反应生成碘单质和一氧化氮气体,其化学方程式为:
2NaNO2+4HI = I2 + 2NO↑+ 2H2O +2NaI 。
(1)上述反应的离子方程式为 ,氧化剂是 ,发生氧化反应的物质是 。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,来鉴别亚硝酸钠和食盐。可选用的物质有:①白酒 ②碘化钾淀粉试纸③淀粉④白糖⑤食醋。进行实验时,必须选用的物质有(填写序号) 。
下图是由1— 18号元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
18号元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
请回答下列问题:
(1)物质A的化学式为 。
(2)1molA与足量的B反应转移的电子数 NA。
(3)反应①的离子方程式为 ;
反应②的化学方程式为 。
(4)等质量的H和I分别与足量的盐酸反应时,产生的气体体积比为 。(同温同压时)
(8分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解,并得到蓝色溶液。该反应的化学方程式为:_________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,若被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为__________________________________。
(3)根据下图操作及现象推断酸X为______________(填序号)。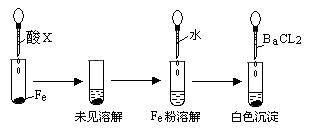
a、浓盐酸 b、浓硫酸 c、浓硝酸
实验室欲配制80mL 1.4mol/L的NaNO3溶液,试回答:
(1)用不到的仪器是: ;
A.烧杯 B.500mL容量瓶 C.圆底烧瓶 D.胶头滴管 E.玻璃棒
(2)配制时应称取NaNO3 g;
(3)在配制一定物质的量浓度溶液的实验中,下列操作会使所配溶液的浓度偏大的是 。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
B.未将洗涤烧杯内壁的溶液转移入容量瓶;
C.称量NaNO3固体时天平指针偏向左方
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶 中时,有少量溅出;
中时,有少量溅出;
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
F.定容时俯视液面
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究。
甲同学设计了如下图所示的实验装置并进行实验: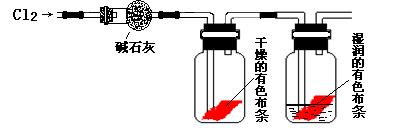
(1)甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因
(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是 ,由此得出Cl2使有色物质褪色的机理是  ;
;
(3)乙同学认为甲设计的实验装置即使改进后还缺少一装置。缺少的装置中发生的离子反应方程式为
(6分)某石灰石样品中含有少量SiO2杂质。5.0g样品与50mL 2mol/L盐酸充分反应后,得到1064mL CO2(标准状况)。计算:
(1)石灰石样品中SiO2的质量分数为
(2)中和多余盐酸所需要1mol/L NaOH溶液的体积为  mL。
mL。
 后,结果得到沉淀3.9g。
后,结果得到沉淀3.9g。 应的离子方程式:
应的离子方程式: 粤公网安备 44130202000953号
粤公网安备 44130202000953号