安徽知名省级示范高中高三第一次联合统考(理综)化学部分
祖母绿是含铬(以Cr2O2形式存在)等微量元素的矿物,其主要成分为Be3Al2Si6O18(Be3Al2Si6O18为无色透明),下列说法不正确的是 ( )
| A.祖母绿是一种硅酸盐矿物 |
| B.其主要成分可用氧化物形式表示:3BeO·Al2O3·6SiO2 |
| C.绿色是Cr2O3表现出来的 |
| D.祖母绿是多种氧化物组成的混合物 |
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
| A.100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子 数为0.3NA |
| B.含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2的数目为NA |
| C.1L 0.1mol/L Na2CO3溶液中,阴阳离子总数为0.3NA |
| D.16.0g的过氧(根)离子中含有的电子数为9NA |
对于反应A2(g)+3B2(g)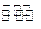 2C(g)△H<0
2C(g)△H<0 ,下列说法错误的是 ( )
,下列说法错误的是 ( )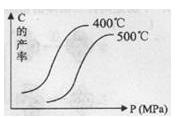
| A.其它条件不变,降低温度,该反应的平衡常数增大 |
| B.使用催化剂能使平衡向生成C的方向移动,并放出更多的热量 |
| C.C的产率与温度、压强(P)关系的示意图如右图: |
| D.恒温恒容时,若密闭容器内压强不再改变,则表示该反应达到平衡 |
下列各组离子或分子在溶液中能大量共存,且加入金属Al后有气体放出的一组是( )
A.Al3+、SO2-4 、NH3·H2O、Cl- 、NH3·H2O、Cl- |
B.Na+、NO-3、H+、Fe2+ |
C.K+、Fe3+、H2SO3、SCN- | D.K+、OH-、NO-3、AlO2或[Al(OH)4] |
下列各组解释合理的是 ( )
| |
物质的检验、制备和用途及实验现象 |
解释 |
| A |
在一定浓度的乙酸溶液中加入少量乙酸钠固体,溶液pH增大 |
完全是由于乙酸根水解所致 |
| B |
向少量未知溶液中滴加氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO2-4 |
| C |
常温下可用铁或铝制容器来盛装浓硫酸或浓硝酸 |
铁、铝表面发生了钝化现象 |
| D |
向饱和NaCl溶液中通入足量的NH3和CO2,有NaHCO3固体析出 |
NaHCO3是难溶于水的盐 |
某原电池装置如右图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是 ( )
| A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B.此电池工作原理与硅太阳能电池工作原理相同 |
| C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑ |
| D.原电池装置中的盐桥完全可用金属导线代替 |
下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、W、J是7种元素的代号。回答下列问题时,涉及元素书写的请用相应的元素符号。
(1)J基态原子的核外电子排布式为 。基态Q2+中未成对电子数为 ;R和Y的简单离子与Na+三种离子的半径大小顺序为 。
(2)X、Y、Z三种元素电负性由大到小的排序是 ;X与Y的第一电离能:X Y(填“<”“>”或“=”),其理由是 。
(3)检验某溶液中是否含有Q3+的方法是 。
(4)已知WX3是一种引爆剂,受撞击时分解为两种单质,则其化学方程式为
。
(5)化学家直到1971年利用XeZ2(Xe为氙)和含JY—3的溶液反应才制得JY-4。反应中除生成JY-4外,还得到了Xe和一种弱酸。写出该离子反应方程式并标出电子转移方向和数目: 。
美日三名化学家[理查德·赫克(Richard Heck,美)、根岸荣—(Ei – ich Negishi,日)、铃木章(Akira Suzuki,日)利用钯(Pd)作催化剂,将有机化合物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为(R – X中的R通常是不饱和烃基或苯环;R′CH=CH通常是丙烯酸酯或丙烯腈等):
现有A、B、C、D等有机化合物有如下转化关系:
请回答下列问题:
(1)反应I的化学方程式为 。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加氢的化学方程式: 。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为
。
(4)写出B转化为C的化学方程式: 。
(5)D的结构简式为(必须表示出分子的空间构型) 。
(6)D具有化学性质有(填编号) 。
A.加热能与氢氧化钠溶液反应
B.能使溴的四氯化碳溶液褪色
C.能发生缩聚反应和加聚反应
D.能使酸性高锰酸钾溶液褪色
(7)已知:醛基直接与苯环连接的醛如 不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式: 。
不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式: 。
①波谱分析显示分子中没有甲基;
②1,3,5—三取代苯;
③具有酸性,既能与Fe3+作用显色,又能使溴水褪色,易被新制的氢氧化铜氧化
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
I.工业上有多种方法来制备氮氦化硅,常见的方法有:
方法一 直接氦化法:在1300~1400℃时,高纯粉状硅与纯氦气化合,其反应方程式为
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氦气、氢气反应生成氦化硅和HCl,与方法一相比,用此法制得的氦化硅纯度较高,其原因是 。
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体
(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
II.(1)氨化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氨化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有 。
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)==Si3N4(s) △H=—750.2kJ/mol
Si(s)+2Cl2(g)==SiCl4(g) △H=—609.6kJ/mol H2(g)+
H2(g)+ Cl2(g)==HCl(g) △H=—92.3kJ/mol
Cl2(g)==HCl(g) △H=—92.3kJ/mol
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:
。
III.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X,高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)原料B的主要成分是 。
(2)写出焦炭与原料B中的主要成分反应的化学方程式: 。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu? (填“能”或“不能”)。
写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极: ;阴极: 。
某实验探究小组根据乙醛还原新制Cu(OH)2的实验操作和实验现象。对反应方程式“CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
(一)查阅资料
(1)质量分数为10%的NaOH溶液密度为1.1g·cm-3,该溶液的c(NaOH)= mol/L;质量分数为2%的CuSO4溶液密度为1.0g·cm—3,其c(CuSO4)=0.125mol/L。
(2)Cu(OH)2可溶于浓的强碱溶液生成深蓝色
的[Cu(OH)4]2-溶液,CuSO4溶液与NaOH
溶液反应过程中Cu2+与[Cu(OH)4]2—浓度
变化如右图所示:
(3)Cu2O、CuO均可溶于CH3COOH;在溶液中
可发生2Cu+==Cu+Cu2+反应。
(二)实验操作及实验现象
(1)在2mL 10%的NaOH溶液中滴加4~6滴(约0.2mL)2%CuSO4溶液,经测定混合溶液中c(OH-)约为2.5mol/L。
(2)若对上述混合物进行过滤,可得到浅蓝色的 (填化学式)固体,滤液呈深蓝色,则显深蓝色的离子是 (填离子符号)。
(3)在第(1)步所得的混合物中加入0.5mL 乙醛,加热至沸腾,产生砖红色沉淀。
(三)对“CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O”质疑的理由:
CH3COOH+Cu2O↓+2H2O”质疑的理由:
(1) ;(2) 。
(四)结论:根据上述探究,乙醛与新制Cu(OH)2反应的离子方程式为
。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号