四川省南充高中高三第四次月考化学试卷
下列叙述不正确的是
| A.蔗糖、麦芽糖、淀粉溶液本身均不能发生银镜反应,但水解后均能发生银镜反应。 |
| B.铅蓄电池在放电过程中,负极、正极质量均增加。 |
| C.胶体能稳定存在的主要原因是同种胶粒带同种电荷。 |
| D.石油裂化的主要目的提高轻质油(如汽油)的产量。 |
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)  CH3OH(g);ΔH<0。第2 min时只改变一个条件,反应情况如下表:
CH3OH(g);ΔH<0。第2 min时只改变一个条件,反应情况如下表:
| 时间 |
c(CO)/ mol/L |
c(H2)/mol/L |
c(CH3OH)/ mol/L |
| 起始 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.2 |
| 第4 min |
0.4 |
1.8 |
0.6 |
| 第6 min |
0.4 |
1.8 |
0.6 |
下列说法不正确的是
| A.第4 min至第6 min该化学反应处于平衡状态 |
| B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 |
| C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 |
| D.第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
下列说法正确的是
A.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c (SO42-)> c (Na+)> c (NH4+)> c (OH-) =" c" (H+)
B.常温下0.4mol/LHB溶液 和0.2mol/LNaOH溶液等体积混合后溶液的PH=3则溶液中微粒浓度存在下面关系:c(HB)>c(Na+)>c(B-)> c(H+) >c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH< 7
D.用惰性电极电解含有一定浓度的CuSO4溶液,一段时间后需加入0.1molCu(OH)2才可以恢复至原来的浓度和体积,则在电解过程中转移了0.4mol电子
通过复习总结,你认为下列对化学知识概括合理的是
| A.物质中只要有阴离子存在就一定存在阳离子,有阳离子存在也一定有阴离子 |
| B.只由非金属元素组成的化合物不可能含有非极性共价键 |
| C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是
| A.电源的M 极为正极 |
| B.甲装置中溶液的pH 减小 |
| C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1 |
| D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液 |
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象: ①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1mol NH4CuSO3完全反应转移0.5mol电子 |
| D.刺激性气味的气体是氨气 |
下面的右图的分子酷似左图的企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone。下列有关Penguinone的说法不正确的是( )
| A.若Penguinone与一取代的酚类互为同分异构体,则这种酚类的同分异构体有9种 |
| B.Penguinone分子中至少有11个原子必处于同一平面 |
| C.Penguinone能使酸性高锰酸钾溶液褪色 |
| D.1mol Penguinone能与3mol氢气反应 |
有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是有碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,不正确的是
A.A、B的相对分子质量之差为42
B.B分子自身可发生缩聚反应生成高分子化合物
C.A的分子式是C7H6O3
D.B能与NaOH溶液、FeCl3溶液、溴水等物质反应
下图中P为一可自由滑动的活塞,K为容器A和B之间的旋塞。将K关闭,在A中充有1molX和1molY,B中充有3molX和3molY。起始时,V(A)=V(B)=1L,在相同的温度和有催化剂存在的条件下,两容器中各自发生反应:
X(g)+Y(g) 2Z(g)+W(g);△H<0。
2Z(g)+W(g);△H<0。
当达到平衡时,V (A)=1.25L。问:
(1)A中Y的转化率为 ,A、B中Y的转化率的关系是a(A) a(B)(填“<”、“>”或“=”)。
(2)如果将B端改装成与A端一致(如下图),
将K关闭,达到平衡后,B的体积为______L,
B中X的体积分数为___________________。
此时,如果将K打开,A中活塞_________(填“移动”或“不移动”,)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(1)元素T在周期表中位于第_________族。
(2)J和氢组成的化合物A每个分子由4个原子组成,其结构简式为________________,已知充分燃烧agA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是_______________________________。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式为___________________________________________________。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
___ __ _。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:______________________。
(6)其中L、M、R形成的氢化物沸点由高到低的顺序是______________________(用化学式表示)
乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2∶4∶1 。请回答:
(1)乙偶姻的分子式为___________。
(2)X是乙偶姻的同分异构体,属于酯类,且能发生银镜反应,写出其可能的结构简式:___________________________________ , _____________。
已知: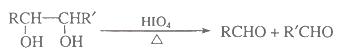
乙偶姻中含有碳氧双键。与乙偶姻有关的反应如下: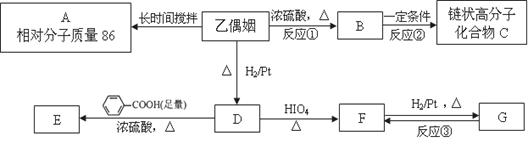
(3)写出反应①、②的反应类型:反应① ______________、反应② ______________。
(4)A的一氯代物只有一种。写出A、乙偶姻、C的结构简式:
A ___________________、乙偶姻____________________、C___________________。
(5)写出D → E反应的化学方程式
___________________________________________________________。
(6)写出F与新制银氨溶液反应的化学方程式
______________________________________________________________________。
某研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号