河南省八市重点高中高三9月教学质量监测考试化学试卷
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
| A.“洧水”的主要成分是油脂 | B.“洧水”的主要成分是煤油 |
| C.烟的主要成分是炭黑 | D.烟的主要成分是石墨 |
下列化学用语正确的是
| A.乙烯的结构简式:CH2CH2 |
| B.次氯酸的结构式:H - Cl-O |
C.原子结构示意图:  |
D. 的电子式: 的电子式: |
向含有c(FeCl3)=0.2 mol·L-l、c(FeCl2)=0.1 mol·L-l的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是
A.该分散系的分散质为 |
B.加入NaOH时发生的反应可能为: |
| C.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 |
| D.可用过滤的方法将黑色金属氧化物与Na+分离开 |
下列操作中,后者最终能被漂白的是
| A.将干燥的氯气与红色鲜花充分接触 | B.将H2 02加入到KMnO4溶液中 |
| C.将足量SO2通人紫色石蕊试液中 | D.将漂白液加入到Fe2 (SO4)3溶液中 |
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是
| A.试剂a是铁、试剂b是稀硫酸 |
| B.操作I、操作Ⅱ、操作Ⅲ所用仪器相同 |
C.试剂c是氯气,相应的反应为: |
| D.用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
下列与滴定实验有关的说法中正确的是
| A.用NaOH滴定盐酸时,只能用酚酞作指示剂 |
| B.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
| C.用滴定管准确量取20.0 mL盐酸 |
| D.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 |
NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA |
| B.0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA |
| C.64 g的SO2与足量的O2充分反应后可得到NA个S03分子 |
| D.标准状况下,2.24 L HF含有的分子数目为0.1NA |
氨基酸分子之间通过氨基与羧基间的取代反应可生成多肽与水,现有两种氨基酸间的反应为: ,则a:b等于
,则a:b等于
| A.4:3 | B.2:3 | C.3:2 | D.3:4 |
已知饱和酸(A)与足量的乙醇(B)在一定条件下生成酯(C),若M(C)=M(A)+56且A分子比B分子多3个碳原子,则上述反应生成的C最多有
A.4种 B.5种 C.6种 D.7种
下列离子方程式正确的是
A.向4 mL FeCl2溶液中滴加两滴浓硝酸: |
B.向石灰水中加入过量的NaHCO3溶液: |
C.铝与稀硫酸反应: |
D.向NH4 Al( SO 4)2加入少量的NaOH溶液: |
原子序数依次增大的四种短周期元素X、Y、Z、W,X与Z同主族且X最外层电子比次外层电子多2个,Y元素的周期序数等于族序数,W元素的最高正价与最低负价代数和为4,下列说法错误的是
| A.最高价氧化物对应水化物的酸性:W>X>Z>Y |
| B.氢化物的稳定性:X>Z |
| C.Y单质可用于钢轨的焊接 |
| D.原子半径大小顺序:X<Y<Z<W |
已知25℃时:①
② 下列有关说法中正确的是
下列有关说法中正确的是
A.HF电离:HF(aq) H+(aq)+F-(aq)△H=+10.4KJ/mol H+(aq)+F-(aq)△H=+10.4KJ/mol |
| B.水解消耗0.1 mol F时,吸收的热量为6.77 kJ |
| C.中和热均为57.3 kJ/mol |
| D.含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量为6.77 kJ |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
C.M电极反应式:  |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |
25℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变 化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是

A.实验甲所得溶液: |
B.将实验甲中所得溶液加水稀释后, 变小 变小 |
| C.a>0.10 |
D.MOH的电离平衡常数可以表示为 |
已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10 -13,下列有关说法错误的是
A.在饱和AgCl、AgBr的混合溶液中: = 360 = 360 |
| B.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 |
| C.AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 |
| D.欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol/L |
Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2。某科学小组通过实验验证反应产物并探究产物的比例关系。资料信息:
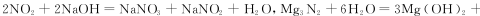
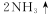
限用如下装置实验(夹持装置省略,部分仪器可重复使用)
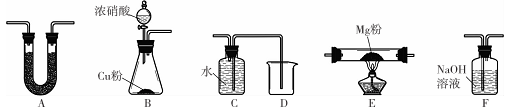
(1)装置连接的顺序为 (填字母序号);
(2)连接好仪器,装入药品前检验装置气密性的方法是____;
(3)装置A中盛装的干燥剂是 ;装置F的作用__ __;
(4)验证产物中存在Mg3 N2的具体实验操作为 .确定产物中有N。生成的实验现象为 ;
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:_ _。
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物。
(1)OF2是一种棕黄色有恶臭的气体,有极强的氧化性。
①OF2中氧元素的化合价为 。
②将Fz通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为____。
(2)过氧化氢是一种绿色氧化剂、还原剂,工业上有多种方法制备H2O2。
①研究表明,H2O2相当于二元弱酸,则它的一级电离方程式为 ,已知常温下1L的H2O2相当于48.3 mol,其K1≈1.67×10 -12.则该温度下H2O2中c(H+)约为 ,写出它与足量Ba(OH)2反应的化学方程式为 。
②乙基蒽醌法是制备过氧化氢最常用的方法,其主要过程可以用下图表示,写出此过程的总反应方程式

③空气阴极法制备H2O2是一种环境友好型、节能型制备方法,电解总方程式 ,
,
则阳极上电极反应式为 。
(3)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式 。
肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂。
(1)已知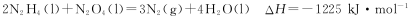
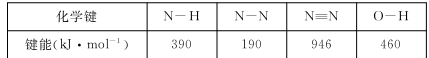
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是 。
(2)800℃时,某密闭容器中存在如下反应: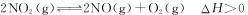 ,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
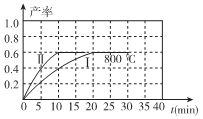
①反应Ⅱ相对于反应I而言,改变的条件可能是 。
②请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线。
③800℃时,若开始时向容器中同时加入1 mol/L NO、0.2 mol/L O2、0.5 mol/L NO2,则v(正)____v(逆)。
(3)己知 ,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
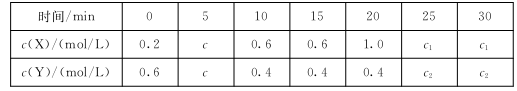
①c( X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②前10 min内用NO2表示的反应速率为 ,20 min时改变的条件是 ;重新达到平衡时,NO2的百分含量 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
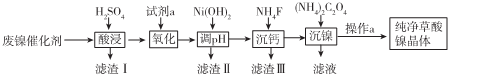
已知草酸镍晶体(NiC2O4,2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
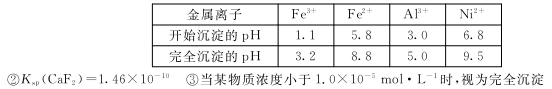
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
(1)请写出一种能提高酸浸速率的措施____。
(2)pH试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式 。
(3)pH的调控范围为 ,试用化学反应原理的相关知识解释滤渣Ⅱ的生成
(4)写出“沉镍”时反应的离子方程式 ,证明Ni2+已经沉淀完全的实验步骤及现象
是 ,当Ca2+沉淀完全时,溶液中c(F-)>(写出计算式即可)。
(5)操作a的内容是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号