2007年全国统一高考化学试卷(广东卷)
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
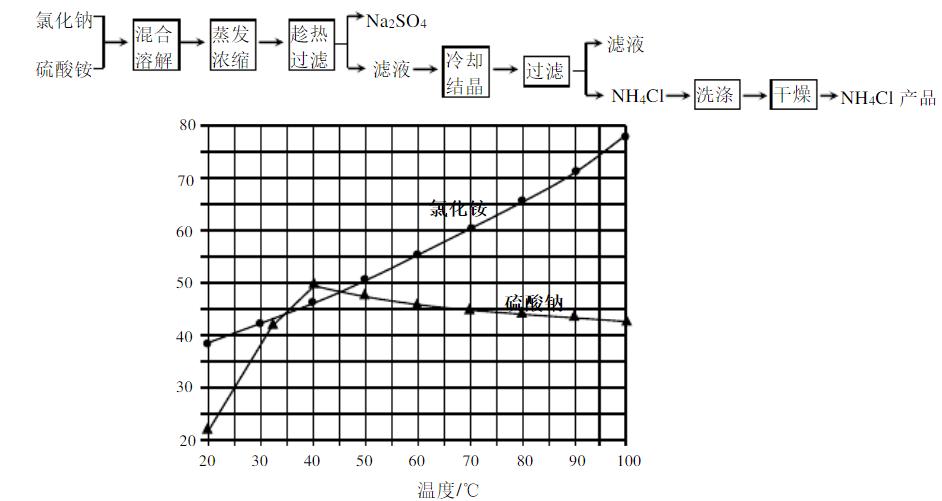
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7
,理论上需
。
(2)实验室进行蒸发浓缩用到的主要仪器有、烧杯、玻璃棒、酒精灯等。
(3)"冷却结晶"过程中,析出
晶体的合适温度为。
(4)不用其它试剂,检查
产品是否纯净的方法及操作是。
(5)若
产品中含有硫酸钠杂质,进一步提纯产品的方法是。
氯气是一种重要的工业原料。工业上利用反应在检查氯气管道是否漏气。下列说法错误的是( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了 的强氧化性 |
| C. | 该反应属于复分解反应 | D. | 生成1 有6 电子转移 |
下列叙述正确的是( )
| A. | 48 气体含有6.02×10 23个 分子 |
| B. | 常温常压下,4.6 气体含有1.81×10 23个 分子 |
| C. | 0.5 溶液中含有3.01×10 23个 |
| D. | 标准状况下,33.6 含有9.03×10 23个 分子 |
下列化学反应的离子方程式正确的是()
| A. | 用小苏打治疗胃酸过多: |
| B. | 往碳酸镁中滴加稀盐酸: |
| C. | 往氨水中滴加氯化铝: |
| D. | 氢氧化钡溶液与稀硫酸反应: |
铋()在医药方面有重要应用。下列关于Bi和Bi的说法正确的是()
| A. | Bi和 都含有83个中子 | B. | Bi和 互为同位素 |
| C. | Bi和 的核外电子数不同 | D. | Bi和 分别含有126和127个质子 |
是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:






(1)的原子核外电子排布式为
(2)三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①分子的空间构型及碳氧之间的成键方式;
②晶体的空间构型及硅氧之间的成键方式;
③已知是离子晶体,写出其主要物理性质(写出2条即可)
(4)可以和很多金属形成配合物,如,与之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知中碳氧键的伸缩振动频率为2060-3,分子中碳氧键的伸缩振动频率为2143-2,则中碳氧键的强度比分子中碳氧键的强度(填字母)
A.强 B.弱 C.相等 D.无法判断
下列说法正确的是()
| A. | 硅材料广泛应用于光纤通讯 | B. | 工艺师利用盐酸刻蚀石英制作艺术品 |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | D. | 粗硅制备单晶硅不涉及氧化还原反应 |
下列符合化学实验"绿色化"的有()
①在萃取操作的演示实验中,将萃取溴水改为萃取碘水
②在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
下列说法正确的是()。
| A. | 石油裂解可以得到氯乙烯 |
| B. | 油脂水解可得到氨基酸和甘油 |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 |
| D. | 淀粉和纤维素的组成都是 ,水解最终产物都是葡萄糖 |
已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1硫酸、2硝酸、2·溶液、20%溶液。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1硫酸、2硝酸、2·溶液、20%溶液。
 完成以下实验探究过程:
完成以下实验探究过程:
 (1)提出假设:
(1)提出假设:
 假设1:该混合金属粉末中除铝外还含有元素;
假设1:该混合金属粉末中除铝外还含有元素;
 假设2:该混合金属粉末中除铝外还含有元素;
假设2:该混合金属粉末中除铝外还含有元素;
 假设3:该混合金属粉末中除铝外还含有、元素;
假设3:该混合金属粉末中除铝外还含有、元素;
 (2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
 (3)实验过程
(3)实验过程
 根据(2)的实验方案,叙述实验操作、预期现象和结论。
根据(2)的实验方案,叙述实验操作、预期现象和结论。
 【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
 Ⅱ.注意文字简洁,确保不超过答题卡空间。
Ⅱ.注意文字简洁,确保不超过答题卡空间。
下列实验操作完全正确的是
| 编号 |
实验 |
操作 |
| A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B |
配制一定浓度的氯化钾溶液1000 | 准确称取氯化钾固体,放入到1000的容量瓶中,加水溶解,振荡摇匀,定容 |
| C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口入出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
为了避免青铜器生成铜绿,以下方法正确的是()
| A. | 将青铜器放在银质托盘上 |
| B. | 将青铜器保存在干燥的环境中 |
| C. | 将青铜器保存在潮湿的空气中 |
| D. | 在青铜器的表面覆盖一层防渗的高分子膜 |
克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):

(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可在一定条件下与氢气反应生成右图所示结构,其反应方程式为(不要求标出反应条件);
反应类型。

(2)化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应,所需另一反应物的分子式为
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正 确的是(填字母)
确的是(填字母)
| A. | 化合物Ⅱ可以与 发生酯化反应 |
| B. | 化合物Ⅱ不可以与金属钠生成氢气 |
| C. | 化合物Ⅲ可以使溴的四氯化碳溶液褪色 |
| D. | 化合物Ⅲ不可以使酸性高锰酸钾溶液褪色 |
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为(不要求标出反应条件)
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为。
下列可用于测定溶液且精确度最高的是()
| A. | 酸碱指示剂 | B. | 计 | C. | 精密 试纸 | D. | 广泛 试纸 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A. | 1.0 溶液: |
| B. | 1.0 溶液: |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的 =5的混合溶液: |
下述实验能达到预期目的的是()
| 编号 |
实验内容 |
实验目的 |
| A. |
将通入酸性溶液中 |
证明具有氧化性 |
| B. |
将通入溶液中 |
比较氯与溴的氧化性强弱 |
| C. |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
| D. |
分别向2支试管中加入相同体积不同浓度的溶液,再向其中1支加入少量 |
研究催化剂对分解速率的影响 |
下列说法正确的是
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C. | 可以分别用置换法、直接加热法和电解法冶炼得到 |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
羟基磷灰石[]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法:用浓氨水分别调和溶液的约为12;在剧烈搅拌下,将溶液缓慢滴入溶液中。
方法:剧烈搅拌下,将溶液缓慢滴加到悬浊液中。
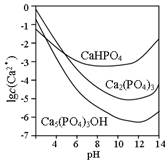
3种钙盐的溶解度随溶液的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法和方法B中制备OH的化学反应方程式:
①·=↓++
②=
(2)与方法相比,方法的优点是。
(3)方法中,如果溶液滴加过快,制得的产物不纯,其原因是。
(4)图中所示3种钙盐在人体中最稳定的存在形式是(填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因。
已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),另一个产物A也呈酸性,反应方程式如下:
苯甲醛 肉桂酸
(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1︰1。产物A的名称是。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为(不要求标出反应条件)
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:

可见,取代基对Perkin反应的影响有(写出3条即可):
①②③
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为
(不要求标出反应条件)
(5)Beck反应中,为了促进反应的进行,通常可加入一种显(填字母)的物质
A 弱酸性 B 弱碱性 C 中性 D 强酸性
 粤公网安备 44130202000953号
粤公网安备 44130202000953号