山西省忻州市高一下学期期末联考化学(A类)试题
下列反应中属吸热反应的是
| A.镁与盐酸反应放出氢气 | B.氢氧化钠与盐酸的反应 |
| C.硫在空气或氧气中燃烧 | D.Ba(OH)2•8H2O与NH4Cl反应 |
下列排列顺序错误的是
| A.酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| B.碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 |
| C.原子半径:F<O<S<Na |
| D.氢化物的稳定性:SiH4>H2S>H2O>HF |
下列有关原子结构和元素周期律的表述正确的是
| A.同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强 |
| B.第ⅠA 族元素的金属性比第ⅡA 族元素的金属性强 |
| C.ⅦA族元素是同周期中非金属性最强的元素 |
| D.原子序数为15的元素的最高化合价为+3 |
在盛有稀H2SO4的烧杯中放入有导线连接的锌片和铜片。下列叙述正确的是
| A.稀硫酸浓度逐渐增大 | B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
同温和同压下,甲、乙两容器分别盛有甲烷气体和氨气,已知它们所含原子数相等;则甲、乙两容器的体积比是
| A.4:3 | B.5:4 | C.4:5 | D.1:1 |
下列物质中既有离子键又有共价键的一组是
| A.NaOH、H2O、NH4Cl | B.KOH、Na2O2、(NH4)2Cl |
| C.MgO、CaBr2、NaCl | D.Na2O、NH3、MgCl2 |
能在无色溶液中大量共存的一组离子是
| A.Ca2+、SO42-、Na+、K+ | B.Fe3+、NO3-、Cl-、H+ |
| C.K+、Al3+、Cl-、OH- | D.H+、Na+、Cl-、SO42- |
若向盛有氯化铁溶液的烧杯中同时加入铁和铜的混合粉末,反应结束后,下列不可能出现的结果是
| A.铁、铜都有剩余,溶液中只有Fe2+ |
| B.铁、铜都不剩余,溶液中可能有Fe3+、一定有Fe2+和Cu2+ |
| C.铁有剩余、铜没剩余,溶液中只有Fe2+、Cu2+ |
| D.铁没剩余、铜有剩余,溶液中一定没有Fe3+ |
有一类矿物被称为石榴石,颜色随成分的不同而变化,其组成可表示为:B3R2(SiO4)3。式中B、R均为金属元素,则B、R的化合价依次为
A.+3、+3 B.+3、+2 C.+2、+2 D.+2、+3
新制氯水,长期存放后,溶液中的下列微粒不会减少的是
| A.Cl2 | B.ClO- | C.Cl- | D.H2O |
下列作用不涉及水解反应的是
| A.吃馒头时多咀嚼后有甜味 |
| B.淀粉溶液和稀H2SO4共热一段时间后,滴加碘水不显蓝色 |
| C.不慎将浓HNO3沾到皮肤上会出现黄色斑痕 |
| D.油脂与NaOH溶液共煮后可以制得肥皂 |
下列反应属于取代反应的是
A.CH4+2O2 CO2+2H2O CO2+2H2O |
B.CH2=CH2+Br2 BrCH2CH2Br BrCH2CH2Br |
C.CH3CH2CH2Cl+NaOH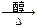 CH3CH=CH2+NaCl+H2O CH3CH=CH2+NaCl+H2O |
D.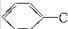 +H2O +H2O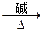 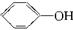 +HCl +HCl |
从海水中提取镁,最基本的方法是往海水里加碱,得到Mg(OH)2沉淀,将沉淀分离出来后再加入盐酸把它变成MgCl2,之后,经过滤、干燥、电解,即可得到金属镁。下面对从海水中提取镁的有关说法中,正确的是
| A.整个过程中没有涉及置换反应 |
| B.往海水中所加的碱不能是Ca(OH)2 |
| C.电解MgCl2溶液即可得到金属镁 |
| D.电解时得到的镁蒸气应在CO2氛围中冷却 |
能用来鉴别四氯化碳、乙醇、己烷、己烯四种无色溶液的一种试剂是
| A.金属钠 | B.溴水 | C.氢溴酸 | D.氢氧化钠溶液 |
下列关于常见有机物的说法不正确的是
| A.乙烯和苯都能与溴水反应 |
| B.乙酸和油脂都与氢氧化钠溶液反应 |
| C.糖类和蛋白质都是人体重要的营养物质 |
| D.乙烯和甲烷可用酸性KMnO4溶液鉴别 |
反应2SO2+O2 2SO3(正反应为放热反应);下列说法不正确的是
2SO3(正反应为放热反应);下列说法不正确的是
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.达平衡状态以后,SO2、O2、SO3的分子数之比是2:1:2 |
| C.当υ正(SO2): υ逆(SO3)=1:1时表明反应达到平衡状态 |
| D.SO2转化率不可能是100% |
等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
A、B、C三支试管中分别盛有Cl-、Br-、I-的溶液,向A试管中加入新制的氯水和CCl4,出现分层,下层为橙红色,再将此溶液倒入C试管中,无变化,则A、B、C三支试管中所盛有的离子依次是
A.I-、Br-、Cl- B.Br-、I-、Cl- C.Cl-、I-、Br- D.Br-、Cl-、I-
有A、B、C、D四种金属,将A与B用导线连接起来浸入电解质溶液中,A被腐蚀;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中,无明显变化;若将铜浸入C的盐溶液中,有金属C析出。据此判断这四种金属的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
控制反应条件可改变化学反应速率。
(1)使用催化剂是改变化学反应速率的一种方法,例如H2O2在MnO2作用下分解,请写出该反应的化学方程式:_____________________________。
(2)经研究发现Fe3+和Cu2+对H2O2的分解也具有催化作用。
某研究小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验,请将他们的实验方案补充完整:
实验目的:_________________________________-
实验试剂:5%H2O2溶液,0.1mol/LFeCl3溶液,0.1mol/LCuSO4溶液
实验仪器:试管、胶头滴管
实验步骤:取两支试管各加入1mL5%H2O2溶液,分别滴加两滴0.1mol/LFeCl3溶液、0.1mol/LCuSO4溶液。
该小组的同学可通过观察______________________以比较出Cu2+和Fe3+的催化效果。
问题与讨论:有同学提出将FeCl3改为Fe2(SO4)3更合理,你认为他的理由是____________________________________________________。
(3)影响化学反应速率的因素除催化剂外,还有______________(答出一种即可),并举一例生产、生活实例加以说明:__________________________。
有X、Y、Z三种元素,已知:①X、Y为短周期元素,且X2-、Y-两种离子均具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液显红色。试回答:
(1)X的最高价氧化物对应水化物的化学式是
(2)将ZY3溶液滴入沸水可得到红褐色胶体,反应的离子方程式是 ,光束通过该液体时形成光亮的“通路”,该现象叫____________。
(3)Na2X的电子式为
(4)X的低价氧化物与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制备氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是
X、Y、Z三种短周期元素,它们的原子序数之和为16。三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图所示变化。已知一个B分子中含有的Z元素的原子个数比C分子中少一个。
请回答下列问题:
(1)X元素在周期表中的位置是 ;Y单质的电子式为 。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由空隙中逸出,并在电极表面放电,则正极通入 (填物质名称);负极电极反应式为 。
(3)A与C在一定条件下反应,该反应是消除硝酸工业尾气污染的原理,其化学方程式是
(4)X、Y、Z三种元素可组成一种强酸W与C反应的离子方程式为:
绿色化学的最大特点在于从开始生产时就采取了污染防治的科学手段,实现生产过程的零污染和生产终端的零污染排放,要实现这种生产方式,就必须充分利用资源中的每一个原子,这种理想的生产方式又被称为“原子经济性”。现有甲、乙、丙3个化肥厂生产尿素,所用的原料不同,但生产的流程相似,其中第①反应都是在一定条件下含碳原料与水的反应:
甲厂:以焦炭、空气和水为原料
乙厂:以天然气、空气和水为原料
丙厂:以石脑油(主要成分C5H12)、空气和水为原料
试回答下列问题:
(1)用化学方程式表示乙厂合成尿素的生产过程。
①_______________________________________
②_______________________________________
③_______________________________________
④_______________________________________
(2)3个化肥厂的原料利用率各不相同,试判断化肥厂对原料的利用率最高的是________,简述原因_______________________________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号