安徽省皖江区域示范高中高三摸底联考化学试卷
“保护环境”是我国的基本国策。下列做法不应该提倡的是
| A.采取低碳、节俭的生活方式 | B.按照规定对生活废弃物进行分类放置 |
| C.在田间焚烧大量秸秆 | D.深入农村和社区宣传环保知识 |
水溶液中能大量共存的一组离子是
| A.NH4+、Ba2+、Br-、CO32- | B.K+、Na+、SO42-、MnO4- |
| C.Na+、H+、NO3-、HCO3- | D.Cl-、NO3-、Fe2+、H+ |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C.Na2O2与足量H2O反应产生0.1molO2,转移电子的数目为0.2NA |
| D.1mol甲醇中含有C—H键的数目为4NA |
下列化学反应的离子方程式正确的是
| A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是
| A.加入催化剂,减小了反应的热效应 |
| B.加入催化剂,可提高H2O2的平衡转化率 |
| C.反应物的总能量高于生成物的总能量 |
| D.H2O2分解的热化学方程式:H2O2 =H2O+1/2O2△H<0 |
下列比较不正确的是
| A.氢化物热稳定性:H2S>HCl | B.酸性:H2SO4>H3PO4 |
| C.碱性:NaOH>Mg(OH)2 | D.离子半径:O2->Na+ |
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.ClO−做还原剂 | B.制备1molK2FeO4时转移3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 | D.Fe(OH)3在反应中被还原,发生还原反应 |
下列有关化学用语表达正确的是
A.HCl的电子式: |
B.氯离子(Cl-)的结构示意图: |
| C.乙酸的结构简式:C2H4O2 | D.质子数为17、中子数为20的氯原子: |
下列关于有机化合物的说法正确的是
| A.聚乙烯分子中含碳碳双键 | B.油脂的皂化反应属于加成反应 |
| C.丁烷有3种同分异构体 | D.以淀粉为原料可以制备乙醇 |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A. |
向AgCl悬浊液中加入稀的NaI溶液 |
出现黄色沉淀 |
Ksp(AgCl)>Ksp(AgI) |
| B. |
在某溶液中加KSCN |
溶液显红色 |
该溶液中有Fe3+,无Fe2+ |
| C. |
在酒精灯上加热铝箔 |
铝箔熔化滴落下来 |
金属铝的熔点较低 |
| D. |
将气体通入澄清石灰水 |
溶液变浑浊 |
该气体一定是CO2 |
下列装置能达到实验目的的是
| A.图1证明酸性:CH3COOH>H2CO3>苯酚 | B.图2用排水法收集NO |
| C.图3萃取碘水中I2,分出水层后的操作 | D.图4验证乙烯的生成 |
下图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录,在卡片上,描述合理的是


| A.①③ | B.①④ | C.②③ | D.③④ |
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.HA为强酸
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A—)> c(HA)
D.pH=7时,c(Na+)=c(A—)+ c(HA)
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
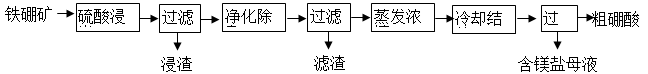
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和 12.4。
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有 。
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、 。
(3)“浸渣”中的物质是 (化学式)。
(4)“净化除杂”需先加H2O2溶液,作用是 ,然后再调节溶液的pH约为5,目的是 。
(5)“粗硼酸”中的主要杂质是 (填名称)。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料在加热条件下可制备单质硼,用化学方程式表示制备过程 。
化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RCHO+CH3COOR’ RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1)A中官能团的名称是 ;C→D的反应类型为 。
(2)B+D→F的化学方程式 。
(3)E的结构简式 。
(4)对于化合物X,下列说法正确的是 。
| A.能发生水解反应 | B.能发生银镜反应 |
| C.不与浓硝酸发生取代反应 | D.能使Br2的CCl4溶液褪色 |
(5)F有多种同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中四个的结构简式是

请写出另外一个同分异构体的结构简式 。
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为 ;该反应发生、气体收集和尾气处理装置依次为 。

(2)按下图装置进行NH3性质实验。
先打开旋塞1,B瓶中的现象是 ,稳定后,关闭旋塞1。再打开旋塞2,B瓶中的现象是 。

(3)写出NH4Cl溶液水解的离子方程式 。
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究 对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积)。
| 物理量 实验序号 |
V(溶液)/mL |
NH4Cl质量/g |
温度/℃ |
|
…… |
| 1 |
250 |
|
|
X |
…… |
| 2 |
250 |
|
|
|
…… |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号