2010年高考化学试题分项专题五 氧化还原反应
下列实验设计及其对应的离子方程式均正确的是
| A. | 用 溶液腐蚀铜线路板: |
| B. | 与 反应制备 : ↑ |
| C. | 将氯气溶于水制备次氯酸: |
| D. | 用浓盐酸酸化的 溶液与 反应,证明 具有还原性: |
↑
亚氨基锂()是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为: ,下列有关说法正确的是
,下列有关说法正确的是
| A. |
中
的化合价是

|
B. | 该反应中 既是氧化剂又是还原剂 |
| C. | 和 的离子半径相等 | D. | 此法储氢和钢瓶储氢的原理相同 |
某研究性学习小组在网上收集到如下信息:溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a. 边振荡盛有2%的溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的增大
【提出假设】
假设1:具有氧化性,能氧化。
假设2:溶液显酸性,在此酸性条件下能氧化。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出,验证了假设1的成立。请写出氧化的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:溶液中的和都氧化了。你是否同意丙同学的结论,并简述理由:。
下列说法不正确的是
| A. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B. | 常温下,反应 不能自发进行,则该反应的 |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| D. | 相同条件下,溶液中 、 、 的氧化性依次减弱 |
正极材料为的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型是一种潜在的锂离子电池正极材料,它可以通过、与溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将和溶液直接混合的原因是。
②共沉淀反应的化学方程式为。
③高温成型前,常向中加入少量活性炭黑,其作用除了可以改善成型后的的导电性能外,还能。
(2)废旧锂离子电池的正极材料试样(主要含有及少量等)可通过下列实验方法回收钴、锂。
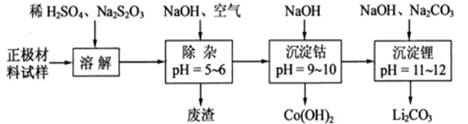
① 在上述溶解过程中,被氧化成,在溶解过程中反应的化学方程式为。
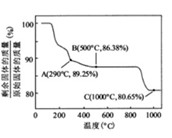
②在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为(填化学式);在350~400℃范围内,剩余固体的成分为。(填化学式)。
向盛有溶液的试管中加入少许后滴加氯水,层 变成紫色。如果继续向试管中滴加氯水,振荡,层会逐渐变浅,最后变成无色。
变成紫色。如果继续向试管中滴加氯水,振荡,层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):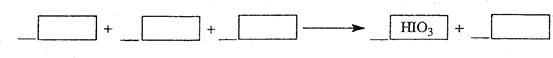
2)整个过程中的还原剂是。
3)把换成,则层变为色:继续滴加氯水,层的颜色没有变化。 、、氧化性由强到弱的顺序是。
4)加碘盐中含碘量为20~50/。制取加碘盐(含的食盐)1000,若庄与反应制,至少需要消耗(标准状况,保留2位小数)。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是,并含少量的、 、等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是。
(2完成"氧化除铁"步骤中反应的离子方程式:
++= +
(3)针铁矿()是以德国诗人歌德()名字命名的,组成元素是、和,化学式量为89,化学式是。
(4)根据下表数据,调节"滤液2"的时,理论上可选用的最大区间为。
| 开始沉淀的 | 10.4 |
6.4 |
- |
- |
| 沉淀完全的 | 12.4 |
8.0 |
- |
- |
| 开始溶解的 | - |
10.5 |
- |
- |
| 5.6×10-12 |
- |
6.8×10-5 |
2.8×10-9 |
(5)工业上从"滤液3"制取过程中,合适的反应物是(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)"滤液4"之后的操作依次为、、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中的质量分数不低于。
能在溶液中大量共存的一组离子是
| A. | 、 、 、 | B. | 、 、 、 |
| C. |
、
、
、

|
D. | 、 、 、 |
某科研小组用和浓盐酸制备时,利用刚吸收过少量的溶液对其发扬进行吸收处理。
(1)请完成与过量溶液反应的化学方程式:+2=。
(2)反应中的还原剂为。
(3)吸收尾气一段时间后,吸收液(强碱性)肯定存在和。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的的影响)
①提出合理假设
假设1:只存在
假设2:既不存在也不存在
假设3:
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3、1、0.01、淀粉-溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3 至溶液呈酸性,然后将所得溶液分置于试管中 |
 |
| 步骤2: |
|
| 步骤3: |
碘被称为"智力元素",科学合理地补充碘可防止碘缺乏病。碘酸钾()是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题:

(1)碘是(填颜色)固体物质,实验室常用方法来分离提纯含有少量杂 质的固体碘。
质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为;阴极上观察到的实验现象是。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有。请设计一个检验电解液中是否有的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。

(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

步骤②的操作名称是,步骤⑤的操作名称是。步骤④洗涤晶体的目的是.

 粤公网安备 44130202000953号
粤公网安备 44130202000953号