广东省广州市番禺区高三第四次统测理综化学试题
下列叙述正确的是
A. O2和 O2和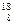 O2互为同位素,化学性质相似 O2互为同位素,化学性质相似 |
| B.C(石墨,s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存 |
钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
| A.反应①、②中电子转移数目不相等 |
| B.反应①中还原剂是氢氧化亚铁 |
| C.反应①属于析氢腐蚀 |
| D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
NA代表阿伏加德罗常数。下列有关叙述正确的是
| A.常温下32g含有少量臭氧的氧气中,共含有2NA个氧原子 |
| B.标准状况下,11.2L氦气中约含有NA个氦原子 |
| C.将NA个NH3分子气体溶于1L水中得到1mol·L-1的氨水 |
| D.100mL0.1mol·L-1醋酸溶液含有的分子总数一定小于0.01NA |
我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示。有关该物质的说法错误的是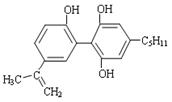
| A.该有机物的分子式为C20H24O3 |
| B.一定条件下1mol该物质能与7molH2发生加成反应 |
| C.该有机物分子中所有的原子不可能在同一平面 |
| D.该有机物若能使酸性KMnO4溶液褪色,则可证明其分子中存在碳碳双键 |
下列有关实验操作的说法正确的是
| A.加入盐酸以除去硫酸钠中的少许碳酸钠杂质 |
| B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| D.可用25.00ml碱式滴定管量取20.00ml 溴水 |
向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系正确的是
| A.Va<Vb时:c (CH3COOH) +c (CH3COO-)>c (K+) | |
B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-) |
C.Va>Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+) |
| D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-) |
下表为短周期元素①~⑧的部分性质。
 元素编号 元素编号元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径/10-10m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
| 最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
| 最低化合价 |
—2 |
|
|
—3 |
—1 |
|
—3 |
|
下列说法正确的是
| A.元素④⑤形成的化合物是离子化合物 |
| B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强 |
| C.元素①⑧形成的化合物具有两性 |
| D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强 |
下图表示反应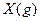

 ,
, ,在某温度时
,在某温度时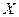 的浓度随时间变化的曲线:
的浓度随时间变化的曲线: 下列有关该反应的描述正确的是
下列有关该反应的描述正确的是
A.第6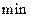 后,反应就终止了 后,反应就终止了 |
B.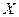 的平衡转化率为85% 的平衡转化率为85% |
C.若升高温度,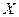 的平衡转化率将大于85% 的平衡转化率将大于85% |
| D.若降低温度,v正> v逆 |
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知: SO2(g) +1/2O2(g)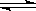 SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
 (4)若以右图所示装置,用电化学原理生产硫酸,写
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为 。
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。 (1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(2)写出反应④的离子方程式: 。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤 产生的 可以用于步
骤 (其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
C(s)+ —O2(g)=CO(g); △H = —110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = —460 kJ•mol-1
(4)煅烧还原的热化学方程式为: 。
(1)下列实验操作或叙述正确的是 (填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加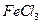 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥定容时,俯视容量瓶刻度,造成所配溶液浓度偏高;
⑦称取5.85g氯化钠固体,用100 mL蒸馏水溶解,得到1.00 mol·L-1氯化钠溶液
(2)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下各步骤的实验:
步骤1测得混合液呈碱性;
步骤2滴加HCl时,溶液中出现气泡。该气体能使饱和石灰水溶液变浑浊; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤4加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
步骤5加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
分析上述5个实验,回答下列问题。
①由实验步骤1判断可能存在的离子有 ;
②由实验步骤2判断可能存在的离子有几种可能性 ;分别是 ;
③由实验步骤3可得出的结论是 ;
④由实验步骤4和实验步骤5可确定肯定存在的离子有 ;
⑤由上述5个实验不能确定是否存在的离子是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号