专题7:物质结构
【2015新课标Ⅰ卷理综化学】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为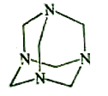
| A.1∶1 | B.2∶3 | C.3∶2 | D.2∶1 |
【2015新课标Ⅰ卷理综化学】W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
| A.单质的沸点:W>X |
| B.阴离子的还原性:W>Z |
| C.氧化物的水化物的酸性:Y<Z |
| D.X与Y不能存在于同一离子化合物中 |
【2015新课标Ⅱ卷理综化学】原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
| A.元素的非金属性次序为c>b>a |
| B.a和其他3种元素均能形成共价化合物 |
| C.d和其他3种元素均能形成离子化合物 |
| D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6 |
【2015山东理综化学】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是
| A.原子半径:X<Y<Z |
| B.气态氢化物的稳定性:X>Z |
| C.Z、W均可与Mg形成离子化合物 |
| D.最高价氧化物对应水化物的酸性:Y>W |
【2015福建理综化学】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是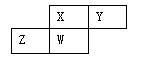
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:X>W>Z |
| C.最简单气态氢化物的热稳定性:Y>X>W>Z |
| D.元素X、Z、W的最高化合价分别与其主族序数相等 |
【2015北京理综化学】下列有关性质的比较,不能用元素周期律解释的是
| A.酸性:H2SO4>H3PO4 | B.非金属性:Cl>Br |
| C.碱性:NaOH>Mg(OH)2 | D.热稳定性:Na2CO3>NaHCO3 |
【2015安徽理综化学】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是
| A.分子式为C3H2O3 |
| B.分子中含6个σ键 |
| C.分子中只有极性键 |
| D.8.6g该物质完全燃烧得到6.72LCO2 |
【2015海南化学】a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
| A.d元素的非金属性最强 |
| B.它们均存在两种或两种以上的氧化物 |
| C.只有a与其他元素生成的化合物都是离子化合物 |
| D.b、c、d与氢形成的化合物中化学键均为极性共价键 |
【2015江苏化学】短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
| A.原子最外层电子数由多到少的顺序:Y、X、W、Z |
| B.原子半径由大到小的顺序:W、Z、Y、X |
| C.元素非金属性由强到弱的顺序:Z、W、X |
| D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
【2015上海化学】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于 的叙述错误的是
的叙述错误的是
| A.原子序数116 | B.中子数177 |
| C.核外电子数116 | D.相对原子质量293 |
【2015上海化学】某晶体中含有极性键,关于该晶体的说法错误的是
| A.不可能有很高的熔沸点 | B.不可能是单质 |
| C.可能是有机物 | D.可能是离子晶体 |
【2015上海化学】不能作为判断硫、氯两种元素非金属性强弱的依据是
| A.单质氧化性的强弱 |
| B.单质沸点的高低 |
| C.单质与氢气化合的难易 |
| D.最高价氧化物对应的水化物酸性的强弱 |
【2015上海化学】将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有
| A.2种 | B.3种 | C.4种 | D.5种 |
【2015上海化学】下列有关物质性质的比较,错误的是
| A.溶解度:小苏打 < 苏打 | B.密度:溴乙烷 > 水 |
| C.硬度:晶体硅 < 金刚石 | D.碳碳键键长:乙烯 > 苯 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号